题目内容
7.实验室配制250ml 0.200mol/L NaCl溶液,下列操作导致所配溶液浓度偏低的是( )| A. | 容量瓶洗净后未干燥 | |
| B. | 移液后烧杯未洗涤 | |
| C. | 定容时俯视读数 | |
| D. | 摇匀后液面低于刻度线再滴加水至刻度线 |
分析 分析操作对溶质的物质的量n和溶液的体积V,依据c=$\frac{n}{V}$进行误差分析,凡是使n偏大或者使V偏小的操作,溶液浓度偏高,凡是使n偏小或者V偏大的操作,溶液浓度偏低,据此进行判断.
解答 解:A.容量瓶洗净后未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故A错误;
B.移液后烧杯未洗涤,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.定容时,俯视读取刻度,导致溶液体积偏小,溶液浓度偏高,故C错误;
D.加入水后导致配制的溶液体积偏大,溶液浓度偏小,故D正确;
故选BD.
点评 本题考查了一定物质的量浓度溶液配制误差的分析,题目难度不大,明确配制原理结合c=$\frac{n}{V}$进行分析产生的误差,试题培养了学生的分析能力及化学检验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.2,2,4三甲基戊烷的一氯取代物的同分异构体有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.化学与科技?社会?生活有着密切的联系,下列有关说法正确的是( )
| A. | 可吸入颗粒物中含有的铅?镉?铬?钒?砷等对人体有害的元素均为金属元素 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广乙醇?汽油的使用 | |
| C. | 单质硅晶体是将太阳能转化为电能的常用材料 | |
| D. | 新型能源生物柴油和矿物油的主要化学成分相同 |
12.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| C. | 使用生物酶降解生活废水中的有机物,可防止水体的富营养化 | |
| D. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
19.进行的下列实验,不能达到预期目的是( )
| 选项 | 操作 | 实验目的 |
| A | 将一定质量的FeCl3固体加入沸水中 | 配制FeCl3溶液 |
| B | 将一定质量的TiCl4加入大量热水中,充分反应后,过滤,洗涤 | 制取TiO2•xH2O |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 将适量溴水加入KI溶液中,振荡,再加入CCl4,振荡,静置 | 验证Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
17.将17.9gAl、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标准状况),另取等质量的合金溶于过量的稀硫酸中,产生气体10.08L(标准状况).则合金中Cu的质量( )
| A. | 5.4 g | B. | 8.4 g | C. | 4.1g | D. | 9.6g |
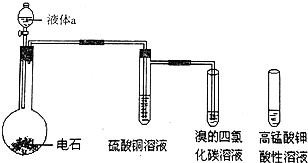 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略. .
.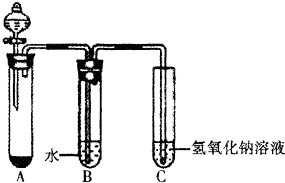 某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).
某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).