题目内容
5.根据你所学知识,判断下列类推结论中正确的是( )| 化学事实 | 类推结论 | |
| A | 常温下,pH=3的盐酸稀释1000倍后pH=6 | 常温下,pH=6的盐酸稀释1 000倍后pH=9 |
| B | 电解熔融MgCl2可制取金属镁 | 电解熔融AlCl3也可制取金属铝 |
| C | Na着火不能用干冰灭火 | K着火也不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸无论任何稀释都不能变为中性或碱性溶液;
B.活泼金属采用电解其熔融盐或氧化物的方法冶炼;
C.Na、K燃烧生成的过氧化物能和二氧化碳反应生成氧气;
D.二氧化硫具有还原性,能被强氧化剂氧化生成硫酸根离子.
解答 解:A.酸无论任何稀释都不能变为中性或碱性溶液,所以常温下,pH=6的盐酸稀释1 000倍后pH接近7但不等于7,要考虑水的电离,故A错误;
B.活泼金属采用电解其熔融盐或氧化物的方法冶炼,氯化铝是共价化合物,熔融状态下不导电,工业上应该采用电解熔融的方法冶炼Al,故B错误;
C.Na、K燃烧生成的过氧化物能和二氧化碳反应生成氧气,促进Na、K燃烧,应该用沙土扑灭,故C正确;
D.二氧化硫具有还原性,能被强氧化剂氧化生成硫酸根离子,所以二氧化硫能被硝酸钡氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及金属原理、物质性质、酸稀释溶液pH变化等知识点,明确实验原理及物质性质是解本题关键,注意从物质性质方面分析评价,易错选项是AB.

练习册系列答案
相关题目
13.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 | |
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H20+O2+4e-═4OH- | |
| C. | 在轮船底镶嵌锌块以保护船体,利用的是牺牲阳极保护法 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
20.某有机化合物只含C、H、O 三种元素且只含有一种官能团,其相对分子质量为58,该有机物完全燃烧时产生等物质的量的CO2和H2O.则它可能的结构共有(不考虑立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
10.实验室存放药品采用分类的方法进行,Na2CO3是实验室常用的一种重要试剂,它不属于下列分类中的( )
| A. | 正盐 | B. | 碱 | C. | 钠盐 | D. | 碳酸盐 |
17.将17.9gAl、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标准状况),另取等质量的合金溶于过量的稀硫酸中,产生气体10.08L(标准状况).则合金中Cu的质量( )
| A. | 5.4 g | B. | 8.4 g | C. | 4.1g | D. | 9.6g |
14.下列有关说法正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒感染,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响,PM2.5引起的雾霾一定属于气溶胶. | |
| C. | 陶瓷、玻璃和光导纤维都是硅酸盐材料 | |
| D. | 原子结构模型的演变经历了: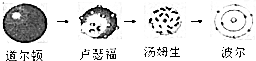 |
12.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
温度试剂
表1
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中
加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%(用代数式表示).
附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到表1的数据:
温度试剂
表1
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:
步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热
(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中
加入10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%(用代数式表示).
附表:溶解度表
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
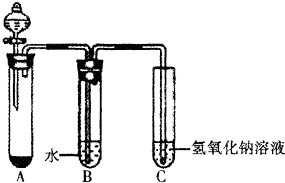 某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).
某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).