题目内容
4.下列正确的叙述有( )①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘酒、淀粉、水雾、纳米材料均为胶体
④灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既为氧化还原反应又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电精炼
⑥氯化铝溶液与氢氧化铝胶体的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 ①能和碱反应生成盐和水的氧化物为酸性氧化物;
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中形成的分散系是溶液;
④氧化还原反应所以前后必须有元素化合价的变化分析;
⑤电离是溶液中水分子或熔融作用下进行;电化腐蚀是形成原电池反应发生的腐蚀;
⑥溶液和胶体能通过滤纸,溶液蒸干灼烧最后得到水解产物分解生成氧化铝;
⑦强电解质是指在水中完全电离成离子的化合物;弱电解质是指在水中不完全电离,只有部分电离的化合物;在水溶液里或熔融状态下都不导电的化合物是非电解质;
⑧金属元素和非金属元素形成的化合物也可以是共价化合物.
解答 解:①NO2和碱反应生成硝酸钠、亚硝酸钠,发生了氧化还原反应,二氧化氮不符合酸性氧化物的定义,故①错误;
②CaCO3+CO2+H2O=Ca(HCO3)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3、2FeCl3+Fe=3FeCl2均可由化合反应制得,故②正确;
③碘晶体分散到酒精中所形成的分散系为溶液,故③错误;
④Ba(OH)2•8H2O与NH4Cl的反应元素化合价不变,不属于氧化还原反应,故④错误;
⑤电解、电泳、电镀需通电,电离是溶液中水分子或熔融作用下进行;电化腐蚀是形成原电池反应发生的腐蚀,不需要通电,故⑤错误;
⑥溶液和胶体能通过滤纸,加热氯化铝溶液时,铝离子水解生成氢氧化铁,蒸干、灼烧时氢氧化铝分解生成氧化铝和水,氢氧化铝胶体加热时聚沉生成沉淀,蒸干、灼烧时氢氧化铝分解生成氧化铝和水,故⑥正确;
⑦氯气不是非电解质,非电解质是化合物,故⑦错误;
⑧金属元素和非金属元素形成的化合物不一定是离子化合物,也可以形成共价化合物,如AlCl3是共价化合物,故⑧错误;
综上所述:②⑥正确;
故选:A.
点评 本题是一道综合题,涉及酸性氧化物、溶液、胶体、电解质、非电解质、离子化合物、电离、电解、电泳、电镀、电化腐蚀等概念的理解和应用,熟练和准确掌握基础是关键.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| C. | 使用生物酶降解生活废水中的有机物,可防止水体的富营养化 | |
| D. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| 选项 | 操作 | 实验目的 |
| A | 将一定质量的FeCl3固体加入沸水中 | 配制FeCl3溶液 |
| B | 将一定质量的TiCl4加入大量热水中,充分反应后,过滤,洗涤 | 制取TiO2•xH2O |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 将适量溴水加入KI溶液中,振荡,再加入CCl4,振荡,静置 | 验证Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | CO2的比例模型: | |
| D. | 质子数为8,质量数为17的原子:${\;}_{8}^{17}$Cl |
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 | |
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H20+O2+4e-═4OH- | |
| C. | 在轮船底镶嵌锌块以保护船体,利用的是牺牲阳极保护法 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒感染,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响,PM2.5引起的雾霾一定属于气溶胶. | |
| C. | 陶瓷、玻璃和光导纤维都是硅酸盐材料 | |
| D. | 原子结构模型的演变经历了: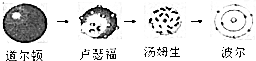 |
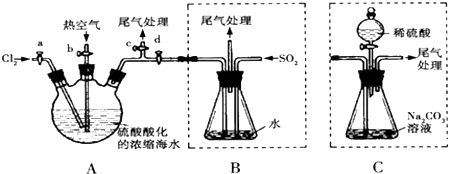
 某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).
某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).