题目内容
16.碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)?HCHO(g)+H2O(g)△H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(2)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(3)用惰性电极电解葡萄糖[CH2OH(CHOH)4CHO]和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].电解过程中,葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
分析 (1)由CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目标反应CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),根据盖斯定律分析求解;
(2)①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26;
②根据三行式求变化量;
(3)葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
解答 解:(1)由CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目标反应CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1,
故答案为:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1;
(2)①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26,故答案为:0.22<n<0.26;
②C8H10(g)?C8H8(g)+H2(g)
开始 0.40mol 0 0
变化 x x x
平衡 0.40mol-x x x
所以:$\frac{0.4+x}{0.4}$=1.4,解之得:x=0.16,所以苯乙烷的转化率为$\frac{0.16}{0.4}$=40%,故答案为:40%;
(3)葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+;
故答案为:阳;CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
点评 本题考查外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写,综合性强,有一定的难度.

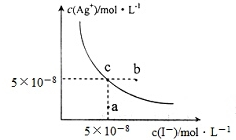
| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
| A. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| B. | 热化学方程式中,如果没有注明温度和压强则表示在标准状况下测得的数据 | |
| C. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态 | |
| D. | 1mol碳燃烧所放出的热量为燃烧热,1mol强酸和1mol强碱完全反应所放出的热称为中和热 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)200℃时,向此密闭容器中充入0.20mol的N2和0.80mol的H2,反应初始6s内达到了平衡状态,N2的平均反应速率v(N2)=0.03mol•L-1•s-1.则6s时NH3的物质的量为0.18mol,c(N2)=0.22mol•L-1;此时N2的转化率为45%,如果这时向该密闭容器中再充入1mol氩气,N2的转化率不变(填“增大”“不变”“减小”).
(3)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2).
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种. .
.