题目内容
在标准状况下,某气体的质量是1.825g,将它完全溶于水,制成500mL的某一元酸(HA)溶液,将此溶液分成相等的两份,取其中的一份加入含有杂质的碳酸钠(杂质不参加反应)1.44g,恰好完全反应,并产生0.28L的气体(标准状况).试求:
(1)碳酸钠的纯度;
(2)一元酸溶液的物质的量浓度;
(3)某气体的相对分子质量;
(4)标况下某气体的密度.
(1)碳酸钠的纯度;
(2)一元酸溶液的物质的量浓度;
(3)某气体的相对分子质量;
(4)标况下某气体的密度.
考点:化学方程式的有关计算
专题:计算题
分析:(1)发生反应:Na2CO3+2HA=2NaA+CO2↑+H2O,生成0.28L为二氧化碳体积,根据n=
计算二氧化碳的物质的量,再根据方程式计算碳酸钠的物质的量,根据m=nM计算碳酸钠的质量,进而计算碳酸钠的纯度;
(2)根据方程式计算250mL溶液中HA的物质的量,再根据c=
计算HA的物质的量浓度;
(3)根据M=
计算HA的摩尔质量,进而确定HA的相对分子质量;
(4)标况下,气体密度ρ=
,据此计算.
| V |
| Vm |
(2)根据方程式计算250mL溶液中HA的物质的量,再根据c=
| n |
| V |
(3)根据M=
| m |
| n |
(4)标况下,气体密度ρ=
| M |
| Vm |
解答:
解:(1)0.28L二氧化碳的物质的量=
=0.0125mol,
Na2CO3+2HA=2NaA+CO2↑+H2O
0.0125mol 0.0125mol
故碳酸钠的质量=0.0125mol×106g/mol=1.325g,
故碳酸钠的纯度=
×100%=92%,
答:碳酸钠的纯度约是92%.
(2)250mLHA溶液与碳酸钠反应生成0.0125mol二氧化碳,则:
Na2CO3+2HA=2NaA+CO2↑+H2O
0.025mol 0.0125mol
故c(HA)=
=0.1mol/L
答:一元酸溶液的物质的量浓度为0.1mol/L.
(3)250mL溶液中HA的物质的量为0.025mol,则500mL溶液中HA为0.025mol×
=0.05mol,则HA的摩尔质量=
=36.5g/mol,故HA的相对分子质量为36.5,
答:该气体的相对分子质量为36.5.
(4)标况下,该气体的密度ρ=
=
=1.63g/L,
答:标况下该气体的密度约是1.63g/L.
| 0.28L |
| 22.4L/mol |
Na2CO3+2HA=2NaA+CO2↑+H2O
0.0125mol 0.0125mol
故碳酸钠的质量=0.0125mol×106g/mol=1.325g,
故碳酸钠的纯度=
| 1.325g |
| 1.44g |
答:碳酸钠的纯度约是92%.
(2)250mLHA溶液与碳酸钠反应生成0.0125mol二氧化碳,则:
Na2CO3+2HA=2NaA+CO2↑+H2O
0.025mol 0.0125mol
故c(HA)=
| 0.025mol |
| 0.25L |
答:一元酸溶液的物质的量浓度为0.1mol/L.
(3)250mL溶液中HA的物质的量为0.025mol,则500mL溶液中HA为0.025mol×
| 500 |
| 250 |
| 1.825g |
| 0.05mol |
答:该气体的相对分子质量为36.5.
(4)标况下,该气体的密度ρ=
| M |
| Vm |
| 36.5g/mol |
| 22.4L/mol |
答:标况下该气体的密度约是1.63g/L.
点评:本题考查化学方程式的有关计算,明确发生的反应是关键,注意题目中与碳酸钠反应的HA溶液体积为250mL.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
2C(s)+O2(g)=2CO(g)△H=-221.0kJ?mol-1,这个热化学方程式表示( )
| A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 |
| B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 |
| C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 |
| D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量 |
以下集气装置中正确的是( )
A、 CO2的收集 |
B、 NO的收集(液体为H2O) |
C、 O2的收集 |
D、 NH3的收集 (液体为H2O) |
在1L溶有0.1mol NaCl和0.1mol MgCl2的溶液中,Cl-的物质的量浓度为( )
| A、0.05 mol/L |
| B、0.1 mol/L |
| C、0.2 mol/L |
| D、0.3 mol/L |
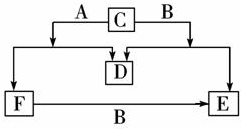 A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
A、B、C、D、E、F六种物质中除D为气体单质外其余均为常见的化合物,E和F的水溶液均呈碱性,且都为重要的化工原料,其焰色反应为黄色,它们的转化关系如图所示.请回答下列问题:
 右图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
右图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)

 )和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出该反应生成过氧化苯甲酰的化学反应方程式: