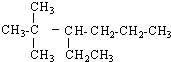��Ŀ����
19������刺��������ʡ�����ըҩ��ɱ������䶳���ȣ���ҵ��ȡ����淋Ĺ���������ͼ1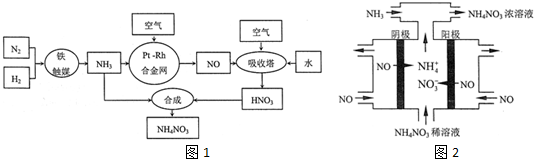
��1���ϳɰ����Ĺ�ҵ�豸���ƺϳ������豸�������Ƚ�������Ŀ���dz���������ܣ��ϳɰ���ԭ��������������Ŀ���Ƿ�ֹ�����ж���
��2���������з�Ӧ�Ļ�ѧ����ʽΪ4NO+3O2+2H2O=4HNO3�����������̿�������������Ҫ�����������ԭ���ǿ�ʹNOѭ�����ã����ԭ�������ʣ�
��3����������Ĺ����г��������������������������ַ���������
����һ��������Һ���շ�
NO+NO2+2NaOH�T2NaNO2+H2O��2NO2+Na2CO3�TNaNO2+NaNO3+CO2
��������NH3��ԭ��
8NH3��g��+6NO2��g���T7N2��g��+12H2O��g����H=-2635kJ/mol��NOҲ�����Ƶķ�Ӧ��
���������������շ�
CH4��g��+2NO2�TCO2��g��+N2+2H2O��g����H=+867kJ/mol��NOҲ�����Ƶķ�Ӧ��
�������ַ����У�����һ����Ҫȱ���ǵ�����NO���ܱ����գ�
�������ͷ�������ȣ���������ȱ���Ǻ��ܸߣ�
��4����ҵ��Ҳ����ͨ�����NO�Ʊ�NH4NO3���乤��ԭ����ͼ2ʾ��
��ͼ��ͨ��NH3��Ŀ����ʹ������ȫ��ת��ΪNH4NO3��
����ά�ֵ���ǿ��Ϊ3A�����2Сʱ�������Ͽ��Ƶ�NH4NO3���������Ϊ6.0g������֪F=96500C•mol-1��������2λ��Ч���֣���
��5��ij���ʳ���NH3�Ʊ�NH4NO3����֪��NH3��NO�IJ�����94%��NO��HNO3�IJ�����89%������HNO3����NH3������ռ�ܺ�NH3������������������ģ��İٷֱ�Ϊ54.4%��
���� �����������ڴ��������¸�ѹ�����·������Ϸ�Ӧ���ɰ����������ڴ��������������·�Ӧ����NO��NO���������������з�Ӧ�������ᣬ����Ͱ�����Ӧ��������泥�
��1���ϳɰ����Ĺ�ҵ�豸���ƺϳ������豸�������Ƚ�������Ŀ���dz���������ܣ���������ѡ���ԣ�
��2�����������ж���������ˮ��Ӧ���������NO��ͨ�������NO�ܱ������е���������Ϊ����������������������ˮ��Ӧ�������ᣬ����ʹNOѭ�����ã�ȫ��ת��Ϊ���
��3������һ����ȱ���ǵ�����NO���ܱ����գ�ֻ����NO2һ�𱻼�Һ���գ��������ͷ�������ȣ��ŵ��Ǽ���Ȱ��۸���ˣ�ȱ���Ƿ������ĺ��ܽϸߣ�
��4���ٹ�ҵ�ϵ��NO�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO����������NO3-������������ԭ��Ӧ��NO����ԭ����NH4+��������ӦΪNO-3e-+2H2O=NO3-+4H+��������ӦΪ��NO+5e-+6H+=NH4++H2O��
�ڸ���ת�Ƶĵ����غ���㣻
��5�����ݵ�ԭ���غ��֪NH3��NO��HNO3���Դ˼��㣮
��� �⣺�����������ڴ��������¸�ѹ�����·������Ϸ�Ӧ���ɰ����������ڴ��������������·�Ӧ����NO��NO���������������з�Ӧ�������ᣬ����Ͱ�����Ӧ��������泥�
��1���ϳɰ��Ĺ�ҵ�豸�Ǻϳ������ϳɰ��ķ�Ӧ���ڷ��ȷ�Ӧ����Ӧ�����л�ų��������ȣ����Ƚ��������Գ���������ȣ���Լ��Դ��N2��H2�ϳ�NH3��������ԭ�����������������Է�ֹ�����ж���
�ʴ�Ϊ���ϳ����� ����������ܣ���ֹ�����ж���
��2�����������ж���������ˮ��Ӧ���������NO��ͨ�������NO�ܱ������е���������Ϊ����������������������ˮ��Ӧ�������ᣬ����ʹNOѭ�����ã�ȫ��ת��Ϊ���ᣬ��Ӧ�Ļ�ѧ����ʽΪ4NO+3O2+2H2O=4HNO3��
�ʴ�Ϊ��4NO+3O2+2H2O=4HNO3����ʹNOѭ�����ã����ԭ�������ʣ�
��3������һ����ȱ���ǵ�����NO���ܱ����գ�ֻ����NO2һ�𱻼�Һ���գ��������ͷ�������ȣ��ŵ��Ǽ���Ȱ��۸���ˣ���Լ�ɱ���ȱ���Ƿ������ķ�Ӧ��Ϊ+867kJ•mol-1�����ܽϸߣ�
�ʴ�Ϊ��������NO���ܱ����գ����ܸߣ�
��4���ٵ��NO�Ʊ�NH4NO3��������ӦΪNO-3e-+2H2O=NO3-+4H+��������ӦΪ��NO+5e-+6H+=NH4++H2O����������Ӧ�ɿ�����Ҫʹ��ʧ�����غ㣬����������NO3-�����ʵ�����������������NH4+�����ʵ������ܷ�Ӧ����ʽΪ��8NO+7H2O$\frac{\underline{\;���\;}}{\;}$3NH4NO3+2HNO3����˲���NH3��ʹ������ȫ��ת��ΪNH4NO3��
�ʴ�Ϊ��ʹ������ȫ��ת��ΪNH4NO3��
��ά�ֵ���ǿ��Ϊ3A�����2Сʱ��ʱ��Ϊ7200S��F=96500C•mol-1��Q=It=3.0C/s��7200S���������Ͽ��Ƶ�NH4NO3���������Ϊ$\frac{3.0C/s��7200s}{\frac{96500C/mol}{3}}$��80g/mol=6.0g
�ʴ�Ϊ��6.0��
��5����NH3��NO�IJ�����94%��NO��HNO3�IJ�����89%�����ݵ�ԭ���غ��֪��NH3��NO��HNO3����1mol�����ɵõ�����1mol��94%��89%=0.8366mol����HNO3+NH3�TNH4NO3����÷�Ӧ���ĵİ��������ʵ���Ϊ0.8366mol������������֮�ȵ������ʵ���֮�ȣ�����HNO3����ȥ��NH3������ռ�ܺ�NH3�����İٷ���Ϊ $\frac{1mol}{1mol+0.8366mol}$��100%=54.4%������HNO3����ȥ��NH3������ռ�ܺ�NH3������54.4%��
�ʴ�Ϊ��54.4%��
���� ���⿼���Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬��ȷ����ͼ�з����ķ�Ӧ������������֮��Ĺ�ϵʽ�ǽⱾ��ؼ������ؿ���ѧ�����������������ѵ����йؼ��㣬��Ŀ�Ѷ��еȣ�

| A�� | HCO3- ��ˮ��Һ��ֻ���룬��ˮ�� | B�� | ��������Һˮ�������� | ||
| C�� | �����Ե����ζ��ܷ���ˮ�ⷴӦ | D�� | �����Ե����ζ�������ˮ�ⷴӦ |
| A�� | 5�� | B�� | 6�� | C�� | 7�� | D�� | 8�� |
| A�� | ��֪2H2��g��+O2��g���T2H2O��g����H=-483.6kJ•mol-1˵��2molH2��g����1molO2��g���������ܺ�С��2molH2O��g�������� | |
| B�� | ��֪C��ʯī��s��=C�����ʯ��s������H��0������ʯ��ʯī�ȶ� | |
| C�� | ��֪NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=-57.4kJ•mol-1����20gNaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ������ | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g����H1�� 2C��s��+O2��g��=2CO��g����H2�����H1����H2 |
| A�� | v��NH3��=0.2mol��L•s�� | B�� | v��O2��=1.4mol��L•min�� | C�� | v��H2O��=0.2mol��L•s�� | D�� | v��NO��=9mol��L•min�� |
 ̼̼˫��
̼̼˫�� 3-��-2-�һ�-1-��ϩ��
3-��-2-�һ�-1-��ϩ�� 2-������
2-������ +3HNO3$��_{��}^{Ũ����}$
+3HNO3$��_{��}^{Ũ����}$ +3H2O��
+3H2O�� 2-������
2-������