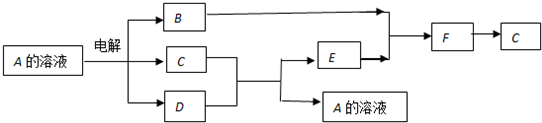
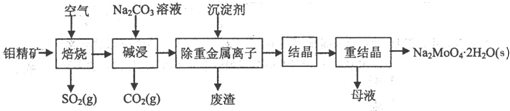
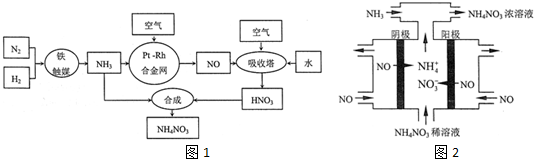
题目内容
18.在科学实验中常涉及水溶液.(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于10-14.酸性溶液中c(H+)>c(OH-)(填“>”、“<”或“=”,下同),pH< 7.
(2)氯化铁水解的离子方程式为Fe3++3H2O≒Fe(OH)3+3H+,配制氯化铁溶液时常加少量盐酸,其作用是抑制氯化铁的水解.
分析 (1)常温下Kw=10-14;溶液的酸碱性,就分析氢离子和氢氧要根离子浓度的相对大小,常温下比较PH的大小;根据c(H+)=10-pH计算;
(2)氯化铁为强酸弱碱盐,水解呈酸性,配制溶液时应防止水解生成沉淀而使溶液变浑浊.
解答 解:(1)常温下Kw=c(H+)×c(OH-)=10-14,当溶液中氢离子的浓度大于氢氧根离子的浓度溶液呈酸性,常温下PH小于7,故答案为:10-14;>;<;
(2)氯化铁为强酸弱碱盐,水解呈酸性,水解离子方程式为Fe3++3H2O≒Fe(OH)3+3H+,配制溶液时应防止水解生成沉淀而使溶液变浑浊,则应加入盐酸,
故答案为:Fe3++3H2O≒Fe(OH)3+3H+;抑制氯化铁的水解.
点评 本题考查了溶液pH的计算、盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,明确pH的计算方法、弱酸溶液中氢离子浓度与溶液pH的关系是解本题关键,难度不大.

练习册系列答案
相关题目
6.如图所示为冰的一种骨架形式,依此为单位向空间延伸,那么该冰中的每个水分子氢键个数为( )

| A. | 1 | B. | 3 | C. | 2 | D. | 4 |
10.首次将量子化概念应用到原子结构,并解释了原子的稳定性的科学家是( )
| A. | 道尔顿 | B. | 爱因斯坦 | C. | 玻尔 | D. | 卢瑟福 |
 ;
;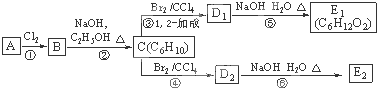
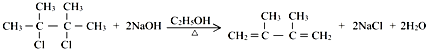 ;
; +Br2→
+Br2→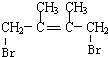 ;
; BaCO3+SO42-.
BaCO3+SO42-.