题目内容
6.将19.2g Cu溶于100mL浓度均为1mol•L-1的HNO3和H2SO4的混合溶液中,若产生的气体为NO,则产生的NO在标准状况下的体积为( )| A. | 2.24 L | B. | 1.68 L | C. | 3.36 L | D. | 1.12 L |
分析 100mL混合酸中含有:n(H+)=0.1L×1mol/L+0.1L×2mol/L=0.3mol,n(NO3-)=0.1L×1mol/L=0.1mol,首先发生反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,19.2g Cu的物质的量为0.3mol,以此计算该题.
解答 解:100mL混合酸中含有:n(H+)=0.1L×1mol/L+0.1L×2mol/L=0.3mol,n(NO3-)=0.1L×1mol/L=0.1mol,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
2 8
0.1mol 0.3mol
0.1molNO3-完全反应消耗0.4molH+,0.3mol小于0.4molH+,故H+不足,由离子方程式可知生成NO为0.3mol×$\frac{2}{8}$=0.075mol,标况下生成NO为0.075mol×22.4L/mol=1.68 L,
故选:B.
点评 本题考查混合物的计算,注意利用离子方程式进行计算解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
17.你认为下列说法正确的是( )
| A. | 冰熔化时只破坏范德华力而不破坏共价键 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 氢键存在于分子之间,也存在于分子之内 |
11.参照反应Br+H2═HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
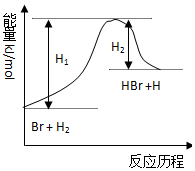

| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不改变 | |
| C. | 逆反应为吸热反应 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
15.某苯的同系物分子式为C10H14,其中能被酸性KMnO4溶液氧化成苯甲酸的同分异构体有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
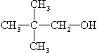 ;
;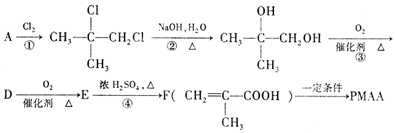

 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O
+2H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$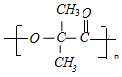 +nH2O.
+nH2O.