题目内容
8.欲将CaCl2溶液中含有的盐酸除掉,应采用的最好方法是( )| A. | 加生石灰,过滤 | B. | 加适量的AgNO3溶液 | ||
| C. | 加过量的Na2CO3溶液 | D. | 加CaCO3粉末,过滤 |
分析 氯化钙溶液因含有盐酸显酸性要变为中性,即是要除去其中的盐酸.注意过程中不能增加其他可溶性的杂质,并要确实把盐酸反应掉,以此解答该题.
解答 解:A.生石灰的主要成分是氧化钙,能与水反应生成氢氧化钙,可以盐酸反应生成氯化钙,反应时无明显现象,不好控制加入的量,故A错误;
B.加入硝酸银,可与氯化钙反应,故B错误;
C.加入过量的碳酸钠,引入新杂质,故C错误;
D.碳酸钙不溶于水,与盐酸反应,可用于除杂,故D正确.
故选D.
点评 本题考查混合物分离、提纯方法的选择和应用,为高频考点,把握物质的性质及分离、提纯方法为解答的关键,侧重除杂的考查,注意除杂的原则,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子.向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)( )
| A. | ① | B. | ①②④ | C. | ①③⑤ | D. | ①③④⑤ |
19.为了除去硝酸钾晶体中所含的硝酸钙和硫酸镁,先将它配成溶液,然后加入几种试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂及顺序正确的是( )
| A. | NaOH--Na2CO3--BaCl2--HCl | B. | NaOH--BaCl2--Na2CO3--HCl | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | KOH--Ba(NO3)2--K2CO3--HNO3 |
3.对于溶液中的反应:2KMnO4+10FeSO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,下列措施能使化学反应速率提高的是( )
| A. | 加水 | B. | 增加同浓度FeSO4的用量 | ||
| C. | 加压 | D. | 加入少量KMnO4晶体 |
13.分类是化学学习与研究的常用方法,下列符合如图的从属关系的是( )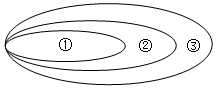

| A. | ①CO、②酸性氧化物、③氧化物 | B. | ①Na2CO3、②钠盐、③碳酸盐 | ||
| C. | ①胶体、②分散系、③混合物 | D. | ①单质、②化合物、③纯净物 |
20.稀氨水中存在着下列平衡:NH3•H2O?NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体,②加热,③硫酸,④水,⑤NaOH固体,⑥加入少量MgSO4固体.
①NH4Cl固体,②加热,③硫酸,④水,⑤NaOH固体,⑥加入少量MgSO4固体.
| A. | ①②③⑤ | B. | ⑤ | C. | ③⑥ | D. | ③⑤ |
17.你认为下列说法正确的是( )
| A. | 冰熔化时只破坏范德华力而不破坏共价键 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 氢键存在于分子之间,也存在于分子之内 |