题目内容
11.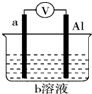 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.(1)若a为镁、b为FeCl3,则负极材料为Mg,正极的电极反应式为Fe3++e-=Fe2+.
(2)若a为铜、b为浓硝酸,则电流的方向为铝→铜(填电极材料),正极的电极反应式为2H++NO3-+e-=H2O+NO2↑.
(3)在一定条件下甲烷和氧气能形成燃料电池.电解液为酸性.则负极电极反应式为CH4-8e-+2H2O=CO2+8H+;该电池工作过程中,H+的移向正极(填“正极”或“负极”).
分析 (1)若a为镁、b为FeCl3,则镁比铝活泼,负极为镁发生氧化反应,正极上三价铁离子得电子发生还原反应;
(2)若a为铜、b为浓硝酸,铝与浓硝酸发生钝化,则铜为负极发生氧化反应,铝为正极发生还原反应,电流的方向为正极到负极;
(3)酸性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4-8e-+2H2O=CO2+8H+,原电池工作时,电解质溶液中,阳离子向正极移动,阴离子向负极移动.
解答 解:(1)若a为镁、b为FeCl3,则镁比铝活泼,负极为镁发生氧化反应,正极上三价铁离子得电子发生还原反应,反应式为:Fe3++e-=Fe2+,
故答案为:Mg;Fe3++e-=Fe2+;
(2)若a为铜、b为浓硝酸,铝与浓硝酸发生钝化,则铜为负极发生氧化反应,铝为正极发生还原反应反应式为:2H++NO3-+e-═H2O+NO2↑,电流的方向为正极铝到负极铜,
故答案为:铝,铜;2H++NO3-+e-═H2O+NO2↑;
(3)酸性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4-8e-+2H2O=CO2+8H+,原电池工作时,电解质溶液中,阳离子向正极移动,则氢离子向正极移动,
故答案为:CH4-8e-+2H2O=CO2+8H+;正极.
点评 本题考查原电池的组成和工作原理,注意把握以镁、铝为电极材料,电解质溶液的酸碱性不同,电极反应不同,燃料电池电极方程式书写中注意电解质溶液的酸碱性,为易错点.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
2.下列物质在给定条件下能实现转化的是( )
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu |
19.某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
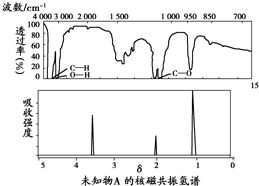

| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 由核磁共振氢谱无法得知其分子中的氢原子总数 |
6.下列关于有机化合物的说法正确的是( )
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 糖类、油脂和蛋白质均可发生水解反应 | |
| D. | 油脂皂化反应得到高级脂肪酸盐与甘油 |
20.下列关于苯的说法中,正确的是( )
| A. | 通入氢气即可发生加成反应 | |
| B. | 分子中含有3个C-C单键和三个C═C双键 | |
| C. | 分子中C、H元素的质量比为6:1 | |
| D. | 在空气中燃烧时产生浓烈的黑烟 |
1.下表是元素周期表的一部分,针对表中的①-⑧种元素,填写下列空白;
(1)上述元素中,形成化合物种类最多的是C(填元素符号);
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
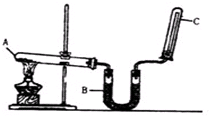 实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题:
实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题: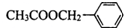 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: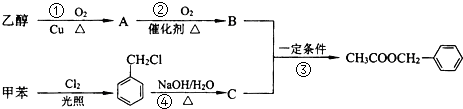
 +H2O$→_{△}^{氢氧化钠}$
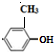
+H2O$→_{△}^{氢氧化钠}$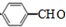 ;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式:
;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式: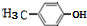
 .
.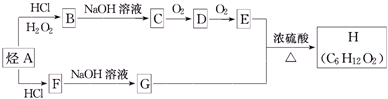
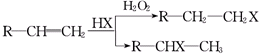 (X为卤素原子)
(X为卤素原子)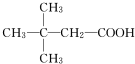 (用结构简式表示).
(用结构简式表示).