题目内容
20.下列关于苯的说法中,正确的是( )| A. | 通入氢气即可发生加成反应 | |
| B. | 分子中含有3个C-C单键和三个C═C双键 | |
| C. | 分子中C、H元素的质量比为6:1 | |
| D. | 在空气中燃烧时产生浓烈的黑烟 |
分析 A.苯和氢气在一定条件下发生加成反应生成环己烷;
B.苯分子中不存在碳碳单键和碳碳双键;
C.苯中C、H原子个数之比为1:1,其质量之比为12:1;
D.苯分子中含碳量较高,在空气中燃烧产生浓烈的黑烟.
解答 解:A.苯与氢气的反应是C6H6+H2 $\stackrel{催化剂}{→}$C6H12,需要加入催化剂才能反应,故A错误;
B.苯分子中不含碳碳双键,苯环结构中不存在C-C单键与C=C双键的交替结构,是介于单键双键之间的独特的键,故B错误;
C.苯的分子式是:C6H6,C、H元素的质量为12:1,故C错误;
D.由于苯分子中含碳量较高,在空气中不易完全燃烧而产生浓烈黑烟,故D正确;
故选C.
点评 本题以苯为载体考查有机物结构和性质,为高频考点,明确苯结构特点、苯的性质是解本题关键,注意:苯中不存在碳碳双键,苯能使溴水褪色不是发生加成反应,而使发生萃取,易错选项是B.

练习册系列答案
相关题目
10.沸腾时只需克服范德华力的液体物质是( )
| A. | 水 | B. | 酒精 | C. | 四氯化碳 | D. | 氨水 |
8.硼有两种天然同位素${\;}_{5}^{10}$B、${\;}_{5}^{11}$B,假设硼元素的相对原子质量为10.2,则${\;}_{5}^{11}$B的质量分数为( )
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
12.下列实验操作能达到预期实验目的是( )
| A. | 为检验卤代烃中的卤原子,先加入NaOH溶液加热,再加入AgNO3溶液观察颜色变化 | |
| B. | 为制取乙酸乙酯,将稀H2SO4和乙醇、乙酸混合加热,放出的蒸气通入盛有NaOH溶液的试管中 | |
| C. | 为检验醛基的存在,先向试管中加入2mL2%的NaOH溶液和数滴CuSO4溶液,再加乙醛,煮沸 | |
| D. | 为制取乙烯,将稀H2SO4和乙醇混合加热 |
8.化合物A、B是中学常见的物质,其阴阳离子可从表中选择
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则
①A中的化学键类型为离子键、共价键(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ仅有I-被氧化成I2使溶液呈黄色.ⅡI-、Fe2+均被氧化使溶液呈黄色.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为NO3-+4H++3e-═NO↑+2H2O.
| 阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
| 阴离子 | OH-、I-、NO3-、AlO2-、HCO3-、HSO4- |
①A中的化学键类型为离子键、共价键(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程式为H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ仅有I-被氧化成I2使溶液呈黄色.ⅡI-、Fe2+均被氧化使溶液呈黄色.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为NO3-+4H++3e-═NO↑+2H2O.
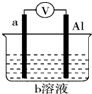 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.