题目内容
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
| A、铜和硝酸反应 |
| B、二氧化碳通入氢氧化钠溶液中 |
| C、细铁丝在氯气中燃烧 |
| D、氯化铝与氢氧化钠溶液反应 |
考点:硝酸的化学性质,氯气的化学性质,钠的重要化合物
专题:
分析:A.Cu和浓硝酸反应生成NO2、和稀硝酸反应生成NO;
B.二氧化碳和少量NaOH反应生成NaHCO3、和过量NaOH反应生成Na2CO3;
C.无论铁是否过量,铁在氯气中燃烧都生成氯化铁;
D.氯化铝和少量NaOH反应生成Al(OH)3、和过量NaOH反应生成NaAlO2.
B.二氧化碳和少量NaOH反应生成NaHCO3、和过量NaOH反应生成Na2CO3;
C.无论铁是否过量,铁在氯气中燃烧都生成氯化铁;
D.氯化铝和少量NaOH反应生成Al(OH)3、和过量NaOH反应生成NaAlO2.
解答:
解:A.Cu+4HNO4(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3=Cu(NO3)2+2NO↑+4H2O,所以生成物与浓度有关,故A错误;
B.NaOH+CO2=NaHCO3、2NaOH+CO2=Na2CO3+H2O,所以生成物与反应物的量有关,故B错误;
C.无论铁是否过量,铁在氯气中燃烧都生成氯化铁,2Fe+3Cl2
2FeCl3,所以与反应物的量、反应物浓度无关,故C正确;
AlCl3+3NaOH=Al(OH)3+3NaCl、4NaOH+AlCl3=NaAlO2+3NaCl+2H2O,所以产物与反应物的量有关,故D错误;
故选C.
B.NaOH+CO2=NaHCO3、2NaOH+CO2=Na2CO3+H2O,所以生成物与反应物的量有关,故B错误;
C.无论铁是否过量,铁在氯气中燃烧都生成氯化铁,2Fe+3Cl2
| ||
AlCl3+3NaOH=Al(OH)3+3NaCl、4NaOH+AlCl3=NaAlO2+3NaCl+2H2O,所以产物与反应物的量有关,故D错误;
故选C.
点评:本题考查产物成分,明确物质的性质是解本题关键,有些反应中产物与反应物的量、反应物浓度或反应条件有关,熟练掌握常见元素化合物性质,题目难度不大,易错选项是C.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
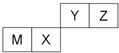

| A、Z位于元素周期表中第2周期、第ⅥA族 |
| B、原子半径Z<M |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、X的最简单气态氢化物的热稳定性比Z的小 |
下列关于乙烯和聚乙烯的叙述中正确的是( )
| A、二者都能使溴水褪色 |
| B、二者互为同系物 |
| C、二者实验式相同 |
| D、二者相对分子质量相同 |
关于常温下pH=3的醋酸溶液,下列叙述正确的是( )
| A、加水稀释10倍后,pH=4 |
| B、加水稀释后,溶液中c(H+)和c(OH-)均减少 |
| C、加入醋酸钠晶体后,溶液的pH增大 |
| D、加入等体积pH=11的NaOH溶液后,溶液呈中性 |
常温时,将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A、pH=9 |
| B、c(OH-)≈10-5mol?L-1. |
| C、pH≈7 |
| D、c(OH-)≈10-8 mol?L-1. |
相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | 放热Q kJ |
| A、容器①、②中反应达平衡时XY3的平衡浓度相同 |
| B、容器①、②中达到平衡时各物质的百分含量相同 |
| C、达平衡时,两个容器中XY3的物质的量浓度均为2 mol?L-1 |
| D、若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
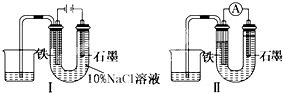 用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )
用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2 |
| B、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
| C、用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D、同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |