题目内容
(1)在室温下测得0.1mol?L-1氨水PH=11,则该温度下氨水的电离度a=
(2)25℃时在0.1mol?L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液.
①当溶液的pH=7时,c(Na+)= (填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为 溶液(填物质的化学式).
(2)25℃时在0.1mol?L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液.
①当溶液的pH=7时,c(Na+)=
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为
考点:酸碱混合时的定性判断及有关ph的计算,水的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)一水合氨为弱电解质,部分电离,电离方程式为NH3?H2O?NH4++OH-,氨水的电离度a=
×100%;
(2)①根据溶液中的电荷守恒来回答;
②根据溶液中的物料守恒知识来回答.
| c(OH-) |
| c(NH3) |
(2)①根据溶液中的电荷守恒来回答;
②根据溶液中的物料守恒知识来回答.
解答:
解:(1)0.1mol?L-1氨水PH=11,则c(OH-)=10-3mol/L,电离方程式为NH3?H2O?NH4++OH-,氨水的电离度a=
×100%=
×100%=1.0%,
故答案为:1.0%;
(2)①根据溶液中的电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当溶液的pH=7时,c(H+)=c(OH-),所以c(Na+)=c(HA-)+2c(A2-),故答案为:c(HA-)+2c(A2-);
②0.1mol?L-1的H2A水溶液中,用氢氧化钠来调节溶液pH,得到含有H2A、HA-、A2-三种微粒的溶液,说明溶液依旧呈酸性,H2A为二元酸,当加入氢氧化钠不足量时,会发生反应:NaOH+H2A=NaHA+H2O,根据物料守恒则有c(Na+)=c(A2-)+c(HA-)+c(H2A),故答案为:NaHA.
| c(OH-) |
| c(NH3) |
| 10-3 |
| 0.1 |
故答案为:1.0%;
(2)①根据溶液中的电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当溶液的pH=7时,c(H+)=c(OH-),所以c(Na+)=c(HA-)+2c(A2-),故答案为:c(HA-)+2c(A2-);
②0.1mol?L-1的H2A水溶液中,用氢氧化钠来调节溶液pH,得到含有H2A、HA-、A2-三种微粒的溶液,说明溶液依旧呈酸性,H2A为二元酸,当加入氢氧化钠不足量时,会发生反应:NaOH+H2A=NaHA+H2O,根据物料守恒则有c(Na+)=c(A2-)+c(HA-)+c(H2A),故答案为:NaHA.
点评:本题综合考查弱电解质在溶液中的电离平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握溶液中的电荷守恒以及物料守恒,难度中等.

练习册系列答案
相关题目
可把苯酚、硫氰化钾、乙醇、氢氧化钠、硝酸银等五种溶液鉴别出来的试剂是( )
| A、浓溴水 |
| B、酚酞溶液 |
| C、NaBr溶液 |
| D、FeCl3溶液 |
下列氯化物中,不能由金属直接与盐酸反应制取的是( )
| A、NaCl |
| B、AlCl3 |
| C、FeCl2 |
| D、AgCl |
对于1L 0.1mol?L-1 NH4Cl溶液,正确的是( )
| A、溶液呈碱性 |
| B、通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| C、溶液中含有NH4+数目为0.1NA(NA表示阿伏加德罗常数的数值) |
| D、升高温度,溶液pH升高 |
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
| A、铜和硝酸反应 |
| B、二氧化碳通入氢氧化钠溶液中 |
| C、细铁丝在氯气中燃烧 |
| D、氯化铝与氢氧化钠溶液反应 |
下列反应不属于氧化还原反应的是( )
| A、2H2O2=2H2O+O2↑ |
| B、CuCl2+2NaOH═Cu(OH)2↓+2NaCl |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、3CO+Fe2O3═2Fe+3CO2 |
 ;(D)
;(D)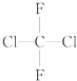 和
和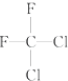 ;(E)甲烷和新戊烷.
;(E)甲烷和新戊烷.