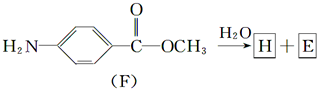题目内容
取50mL NaOH溶液和30mL硫酸进行试验,实验数据如下表:
①请填写表中的空白;
②近似认为0.50mol?L-1 NaOH溶液和0.50mol?L-1“硫酸的密度都是1g?cm-3,比热容c=4.18J?g-1?℃-1.请根据实验数据写出该反应表示中和热的热化学方程式: (取小数点后一位)
①请填写表中的空白;
②近似认为0.50mol?L-1 NaOH溶液和0.50mol?L-1“硫酸的密度都是1g?cm-3,比热容c=4.18J?g-1?℃-1.请根据实验数据写出该反应表示中和热的热化学方程式:
| 温度 试验次数 | 起 始 温 度T1/℃ | 终止温度T2/℃ | 平均温度差 (T2-T1)/℃ | ||
| H2SO4 溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
考点:中和滴定
专题:
分析:①先分析数据的可靠性,再计算其平均值;
②50mLNaOH溶液与30mL硫酸反应,硫酸过量,据NaOH的物质的量计算反应放出的热量,n(NaOH)=0.05L×0.50mol/L=0.025mol,其与硫酸中和放热为:Q=cm△t=4.18J/(g?℃)×80g×△t,再书写热化学方程式,中和热是指生成1mol水时放出的热量.
②50mLNaOH溶液与30mL硫酸反应,硫酸过量,据NaOH的物质的量计算反应放出的热量,n(NaOH)=0.05L×0.50mol/L=0.025mol,其与硫酸中和放热为:Q=cm△t=4.18J/(g?℃)×80g×△t,再书写热化学方程式,中和热是指生成1mol水时放出的热量.
解答:
解:①据表中数据可知,1、2、3、4次温差分别为4.0、6.1、3.9、4.1,第二次温差太大,忽略,所以其平均温差为
℃=4.0℃,
故答案为:4.0;
②Q=cm△t=4.18J/(g?℃)×80g×4.0℃=1337.6J=1.3376KJ,0.025molNaOH反应放热1.3376KJ,1molNaOH反应生成1mol水时放热:
=45.5KJ/mol,所以该反应表示中和热的热化学方程式:NaOH(aq)+
H2SO4(aq)=H2O(l)+
Na2SO4(aq)△H=-45.5KJ/mol,
故答案为:NaOH(aq)+
H2SO4(aq)=H2O(l)+
Na2SO4(aq)△H=-45.5KJ/mol.
| 4.0+3.9+4.1 |
| 3 |
故答案为:4.0;
②Q=cm△t=4.18J/(g?℃)×80g×4.0℃=1337.6J=1.3376KJ,0.025molNaOH反应放热1.3376KJ,1molNaOH反应生成1mol水时放热:
| 1.3376KJ |
| 0.025mol |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了中和热的测定实验以及中和热热化学方程式的书写,注意中和热是指生成1mol水时放出的热量,题目难度较大.

练习册系列答案
相关题目
下列各离子方程书写正确的是( )
| A、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| C、在FeI2溶液中通入少量的氯气:2Fe2++Cl2=2Fe3++2Cl- |
| D、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 1 | 2 | 0 |
| 平衡浓度/mol/L | 0.6 | 1.6 | 0.8 |
| A、增大压强使平衡向生成Z的方向移动,平衡常数增大 | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、反应达到平衡时,Y的转化率为20% | ||
| D、改变温度可以改变此反应的平衡常数 |


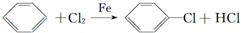
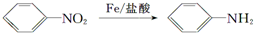 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) 结构.
结构.