题目内容
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 1 | 2 | 0 |
| 平衡浓度/mol/L | 0.6 | 1.6 | 0.8 |
| A、增大压强使平衡向生成Z的方向移动,平衡常数增大 | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、反应达到平衡时,Y的转化率为20% | ||
| D、改变温度可以改变此反应的平衡常数 |
考点:化学平衡的计算
专题:
分析:A.平衡常数只受温度的影响;
B.根据反应速率之比等于化学计量数之比判断化学方程式并计算平衡常数;
C.根据转化率=
×100%计算;
D.平衡常数只受温度的影响.
B.根据反应速率之比等于化学计量数之比判断化学方程式并计算平衡常数;
C.根据转化率=
| 消耗量 |
| 起始量 |
D.平衡常数只受温度的影响.
解答:
解:A.平衡常数只受温度的影响,压强改变时,化学平衡常数仍然不变,故A错误;
B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.4:0.4:0.8=1:1:2,则反应的方程式为X+Y?2Z,K=
=
=
,故B正确;
C.反应达到平衡时,Y的转化率为
×100%=20%,故C正确;
D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定改变,故D正确.
故选:A.
B.根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.4:0.4:0.8=1:1:2,则反应的方程式为X+Y?2Z,K=
| c2(Z) |
| c(X)?c(Y) |
| 0.82 |
| 0.6×1.6 |
| 2 |
| 3 |
C.反应达到平衡时,Y的转化率为
| 0.4mol/L |
| 2mol/L |
D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定改变,故D正确.
故选:A.
点评:本题考查化学平衡的计算及平衡移动问题,题目难度不大,注意平衡常数的计算以及平衡常数为温度的函数的特征来解答.

练习册系列答案
相关题目
核外电子数相同、所显电性和所带电量也相同的微粒称为等电子等质子体.下列各组内的两种微粒属于等电子等质子体的是( )
| A、Na+和Mg2+ |
| B、O2-和Mg2+ |
| C、F-和Cl- |
| D、Na+和NH4+ |
下列说法正确的是(NA代表着阿伏加德罗常数的值)( )
| A、1molNa被完全氧化为Na2O2,失去的电子数为2NA |
| B、常温常压下,16gO3气体含有氧原子数为NA |
| C、常温常压下,22.4LCO2 含有分子数为NA |
| D、18g D2O所含有电子数为10NA |


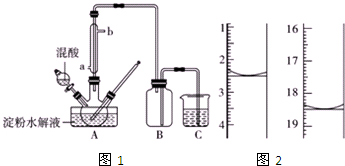 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)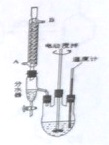 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g?cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂,某实验小组用如图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置已略去).主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g?cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂,某实验小组用如图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置已略去).主要操作步骤如下: