题目内容
11.下列操作中,溶液的颜色不发生变化的是( )| A. | 碳酸氢钠溶液中滴加氢氧化钠溶液 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 氯化亚铁溶液中滴加氯水 | D. | 氯化铁溶液中加入还原铁粉 |
分析 A.碳酸氢钠与NaOH反应生成碳酸钠和水;
B.铁离子与SCN-结合生成血红色的络离子;
C.亚铁离子被氯气氧化生成铁离子;
D.氯化铁与Fe反应生成氯化亚铁.
解答 解:A.碳酸氢钠与NaOH反应生成碳酸钠和水,现象不明显,故A选;
B.铁离子与SCN-结合生成血红色的络离子,溶液由黄色变为血红色,故B不选;
C.亚铁离子被氯气氧化生成铁离子,溶液由浅绿色变为黄色,故C不选;
D.氯化铁与Fe反应生成氯化亚铁,溶液由黄色变为浅绿色,故D不选;
故选A.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
10.如图是工业海水提溴的部分流程,下列有关说法正确的是( )

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
6.下表为元素周期表的一部分,请按要求回答问题:
(1)表中元素F的非金属性最强,元素Na的金属性最强(填元素符号).
(2)表中元素③的原子结构示意图 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式 .
.
(3)表中元素④、⑨形成的氢化物的稳定性顺序为HF>HCl(填化学式).
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为HClO4>H2SO4(填化学式).
(5)表中元素③、④、⑥、⑦的原子半径大小为Na>Mg>O>F(填元素符号).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
(2)表中元素③的原子结构示意图
 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式 .
.(3)表中元素④、⑨形成的氢化物的稳定性顺序为HF>HCl(填化学式).
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为HClO4>H2SO4(填化学式).
(5)表中元素③、④、⑥、⑦的原子半径大小为Na>Mg>O>F(填元素符号).
16.工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:则△H1=-116kJ•mol-1
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
20.下列说法正确的是( )
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| D. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
1.下列用水就能鉴别的一组物质是( )
| A. | 苯、己烷、四氯化碳 | B. | 苯、酒精、四氯化碳 | ||
| C. | 硝基苯、酒精、四氯化碳 | D. | 硝基苯、酒精、醋酸 |

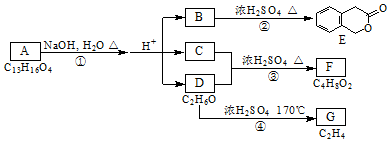
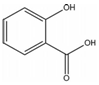 ,其名称为:邻羟基苯甲酸
,其名称为:邻羟基苯甲酸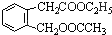 ④反应的反应类型是消去反应
④反应的反应类型是消去反应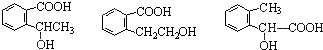 任意一个
任意一个 或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.