题目内容
19.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K==$\frac{{{{[C{O_2}]}^3}}}{{{{[CO]}^3}}}$;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为0.015mol/(L•min);
(2)下列各种情况能说明该反应已达到平衡状态:ADE
A、生成CO的速率等于生成CO2的速率
B、生成CO的速率等于消耗CO2的速率
C、容器内压强不再变化
D、CO的质量不再变化
E、容器内密度不再变化.
分析 (1)①K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能代入K的表达式中;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知,消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,结合v=$\frac{△c}{△t}$计算;
(2)结合平衡的特征“等、定”及衍生的物理量判断.
解答 解:(1)①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数表达式K=$\frac{{{{[C{O_2}]}^3}}}{{{{[CO]}^3}}}$,故答案为:=$\frac{{{{[C{O_2}]}^3}}}{{{{[CO]}^3}}}$;
②n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,由反应可知,消耗CO为0.2mol×$\frac{3}{2}$=0.3mol,则10min内CO的平均反应速率为$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L•min),
故答案为:0.015mol/(L•min);
(2)A、生成CO的速率等于生成CO2的速率,可知正逆反应速率相等,为平衡状态,故A选;
B、生成CO的速率等于消耗CO2的速率,均为逆反应速率,不能判定平衡,故B不选;
C、该反应前后气体的物质的量不变,容器内压强始终不再变化,不能判定平衡,故C不选;
D、CO的质量不再变化,由平衡特征“定”可知,为平衡状态,故D选;
E、气体的质量为变量,则容器内密度不再变化,为平衡状态,故E选;
故答案为:ADE.
点评 本题考查化学平衡计算,为高频考点,把握K的表达式、速率计算及平衡判定为解答的关键,侧重分析与应用能力的考查,注意固体不能代入K中,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积2.24L.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
②取一定体积CO和H2的混合气体(物质的量之比为1:2),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0 (填“>”、“<”或“=”).
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”、“<”或“=”).
④若容器容积不变,下列措施可增加甲醇产率的是BD
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤经测定不同温度下该反应的平衡常数如表:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为O2+4e-=2O2-.电池工作时,固体电解质里的O2-向负极移动.
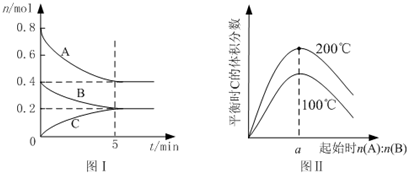
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)+Q(Q>0) | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 由图I可知,该反应式为2A(g)+B(g)?C(g) |
| A. | 碳酸氢钠溶液中滴加氢氧化钠溶液 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 氯化亚铁溶液中滴加氯水 | D. | 氯化铁溶液中加入还原铁粉 |

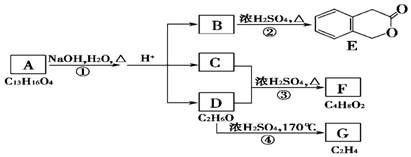
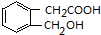
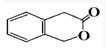 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)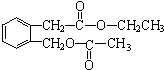 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.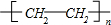 .
.