题目内容
元素周期表前四周期A、B、C、D、E五种元素.A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子.
(1)写出元素名称:C 、D 、E .
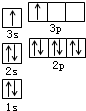
(2)C基态原子的电子排布图为 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”).
(3)当n=2时,B的最简单气态氢化物的电子式为 ,BC2分子的结构式是 ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 .
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示).
(5)E元素原子的特征电子构型是 ,在元素周期表中位置是 ,其最高价氧化物的化学式是 .
(1)写出元素名称:C
(2)C基态原子的电子排布图为
(3)当n=2时,B的最简单气态氢化物的电子式为
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是
(5)E元素原子的特征电子构型是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,原子序数为25,则E为Mn元素,
(1)根据分析选出B、C、D元素的名称;
(2)C为氧元素,氧原子核外电子总数为8,含有2个电子层,据此画出其基态原子电子排布图;A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(3)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;BC2分子为二氧化碳,CO2为直线型结构,分子中存在两个碳氧双键,根据其电子式写出其结构式;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,写出二氧化硅与氢氧化钠溶液反应的离子方程式;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大;
(5)Mn元素的3d轨道处于半满状态,据此写出其特征电子构型;根据Mn元素的原子序数判断其在周期表中位置;锰元素的总共正价为+7价,据此写出其最高价氧化物的化学式.
(1)根据分析选出B、C、D元素的名称;
(2)C为氧元素,氧原子核外电子总数为8,含有2个电子层,据此画出其基态原子电子排布图;A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(3)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;BC2分子为二氧化碳,CO2为直线型结构,分子中存在两个碳氧双键,根据其电子式写出其结构式;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,写出二氧化硅与氢氧化钠溶液反应的离子方程式;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大;
(5)Mn元素的3d轨道处于半满状态,据此写出其特征电子构型;根据Mn元素的原子序数判断其在周期表中位置;锰元素的总共正价为+7价,据此写出其最高价氧化物的化学式.
解答:
解:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,E为Mn元素,
(1)根据分析可知,C为氧元素、D为磷元素、E为锰元素,
故答案为:氧;磷;锰;
(2)C为O元素,氧元素核电荷数为8,核外电子总数为8,氧原子基态原子电子排布图为: ;
;
若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为: ;σ键;
;σ键;
(3)当n=2时,BC元素,其简单氢化物为CH4,甲烷为共价化合物,分子中存在4个碳氢键,其电子式为: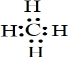 ;
;
BC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为: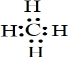 ;O=C=O;SiO2+2OH-═SiO32-+H2O;
;O=C=O;SiO2+2OH-═SiO32-+H2O;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:O>P>Si>Li;
(5)E为Mn元素,Mn元素的3d轨道含有5个电子,处于半满状态,Mn元素原子的特征电子构型为:3d54s2,锰元素的原子序数为25,核外含有4个电子层,位于周期表中第四周期ⅦB族,Mn的最高化合价为+7价,其最高价氧化物的化学式为:Mn2O7,
故答案为:3d54s2;第四周期ⅦB族;Mn2O7.
(1)根据分析可知,C为氧元素、D为磷元素、E为锰元素,
故答案为:氧;磷;锰;
(2)C为O元素,氧元素核电荷数为8,核外电子总数为8,氧原子基态原子电子排布图为:
 ;
;若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:
 ;σ键;
;σ键;(3)当n=2时,BC元素,其简单氢化物为CH4,甲烷为共价化合物,分子中存在4个碳氢键,其电子式为:
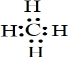 ;
;BC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:
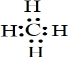 ;O=C=O;SiO2+2OH-═SiO32-+H2O;
;O=C=O;SiO2+2OH-═SiO32-+H2O;(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:O>P>Si>Li;
(5)E为Mn元素,Mn元素的3d轨道含有5个电子,处于半满状态,Mn元素原子的特征电子构型为:3d54s2,锰元素的原子序数为25,核外含有4个电子层,位于周期表中第四周期ⅦB族,Mn的最高化合价为+7价,其最高价氧化物的化学式为:Mn2O7,
故答案为:3d54s2;第四周期ⅦB族;Mn2O7.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见元素的原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及书写原则.

练习册系列答案
相关题目
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪).关于185Hf的下列说法中,正确的是( )
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法正确的是( )
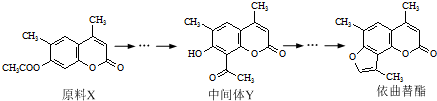

| A、原料X酸性条件下水解产物与中间体Y互为同分异构体 |
| B、原料X不能使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、氧化等反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题: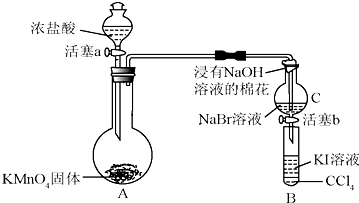
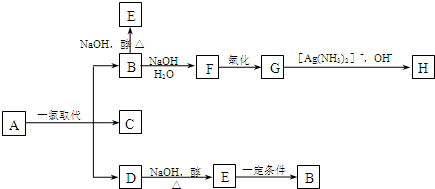
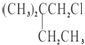 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.