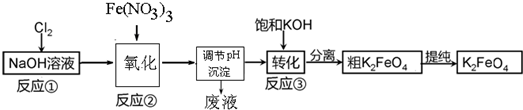
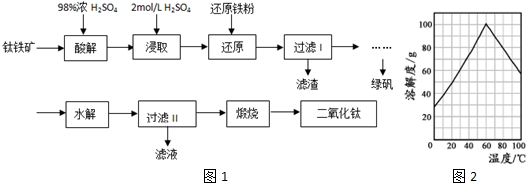
题目内容
13.乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如图:
已知:
①苯胺易被氧化.
②乙酰苯胺、苯胺和醋酸的部分物理性质如表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |
步骤1:在a中,加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照如图装置组装仪器.

步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全.
步骤3:趁热将反应混合物倒入盛有100mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品.
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g.
请回答下列问题:
(1)仪器a的名称为圆底烧瓶,所选仪器a的最佳规格是B(填序号).
A.25mL B.50mL C.100mL D.250mL
(2)实验中加入少许锌粉的目的是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中,控制温度计读数在105℃左右的原因是温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出.
(4)判断反应已基本完全的方法为锥形瓶不再有水增加.
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.
(6)步骤4中粗产品进一步提纯,该提纯方法是重结晶.
(7)本次实验的产率为80%.
分析 (1)根据装置图分析;圆底烧瓶所盛放的溶液体积一般不能超过烧瓶容积的$\frac{2}{3}$,不能低于$\frac{1}{3}$;
(2)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸;
(3)根据乙酸和水的沸点分析;
(4)反应生成水,若不再生成水,说明完全;
(5)若让反应混合物冷却,会有固体析出;
(6)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯.
(7)加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,所以乙酸过量,根据苯胺的物质的量计算出乙酰苯胺的物质的量和质量,再求出产率.
解答 解:(1)根据装置图可知a仪器为圆底烧瓶;反应物液体的总体积超过22mL,由于圆底烧瓶所盛放的溶液体积一般不能超过$\frac{2}{3}$,不能低于$\frac{1}{3}$,因此最佳规格是50mL,
故答案为:圆底烧瓶;B;
(2)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸,
故答案为:防止苯胺被氧化,同时起着沸石的作用;
(3)已知醋酸的沸点为118℃,水的沸点为100℃,温度过高,未反应的乙酸会蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水,故选择控制温度计约105℃,
故答案为:温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出;
(4)反应生成水,水经过加热蒸发、冷凝进入锥形瓶中,若锥形瓶中水的量不再增加,说明反应基本完全,故答案为:锥形瓶不再有水增加;
(5)已知乙酰苯胺的熔点为114.3℃,常温下为固体,若让反应混合物冷却,则乙酰苯胺会以固体形式析出沾在瓶壁上不易处理,故需要“趁热”过滤;
故答案为:若让反应混合物冷却,则固体析出沾在瓶壁上不易处理;
(6)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯,故答案为:重结晶;
(7)加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,所以乙酸过量,按照苯胺的物质的量计算,
设生成的乙酰苯胺为xmol, NH2+CH3COOH$\stackrel{△}{?}$
NH2+CH3COOH$\stackrel{△}{?}$ NHCOOCH3 +H2O
NHCOOCH3 +H2O
1mol 1mol
0.1mol x
则x=0.1mol,所以m(乙酰苯胺)=0.1mol×135g/mol=13.5g,
所以所得到乙酰苯胺的产率是$\frac{10.8g}{13.5g}$×100%=80%;
故答案为:80%.
点评 本题考查有机物制备方案设计,涉及物质的分离提纯、对操作的分析评价、基本操作等,理解实验原理和物质的性质是解题的关键,是对学生综合能力的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 如图可表示Ba(OH)2•8H2O与NH4Cl晶体反应的能量变化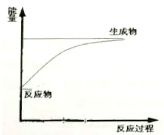 | |
| D. | 1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热 |
N2(g)+2O2(g)═2NO2(g)△H=67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1.
下列关于肼和NO2反应的热化学方程式中正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=1 135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1 135.7 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=1 135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1 135.7 kJ•mol-1 |
| A. | 2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2 | |
| D. | $\frac{1}{2}$ H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2 |
| a(干燥气体) | b(液体) | 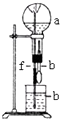 | |
| A | Cl2 | 饱和食盐水 | |
| B | NO+O2(物质的量之比为4:1) | H2O | |
| C | CO2 | NaOH | |
| D | NO2 | H2O |
| A. | A | B. | B | C. | C | D. | D |