题目内容
工业生产上常使用催化剂,因为它可以( )
| A、提高反应进行的程度 |
| B、使平衡向正反应方向移动 |
| C、是生成物更纯净 |
| D、使容器中气体的密度不再发生变化 |
考点:化学平衡的调控作用
专题:化学平衡专题
分析:根据催化剂的定义和催化剂的特点进行分析解答.
解答:
解:催化剂是指在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后不变的物质;有的催化剂能加快反应速度,有的催化剂能减慢反应速度,一定能改变反应速率,不能使平衡发生移动,所以A、B、C错误,在催化剂只改变反应速率,所以不改变平衡的移动,各组分的浓度不变,所以气体的密度也不受其影响,故D正确;
故选D.
故选D.
点评:本题难度不大,掌握催化剂的特点是解答本题的关键.

练习册系列答案
相关题目
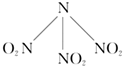 科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )| A、分子中的化学键有极性键和非极性键 |
| B、分子中四个氮原子位于正四面体的顶点 |
| C、该物质的熔、沸点可能比NH3高 |
| D、15.2g该物质含有6.02×1023个原子 |
一定不是同分异构体的一组物质是( )
| A、含相同碳原子数的饱和醛和酮 |
| B、含相同碳原子数的饱和一元羧酸与酯 |
| C、乙醇与乙醚 |
| D、对甲苯酚与苯甲醇 |
下列电离方程式书写不正确的是( )
| A、Al(OH)3?Al3++3OH- |
| B、NaHCO3═Na++HCO3-HCO-3?H++CO32- |
| C、Na2SO4=2Na++SO42- |
| D、HF?H++F- |
C、N、S都是重要的非金属元素.下列说法正确的是( )
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同浓度的Na2CO3、NaNO3、Na2SO3溶液的导电能力相同 |
| D、CO2、NO2、SO2都能与H2O反应生成电解质 |
下列叙述正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、含1mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l)H=-a kJ?mol-1 |
| C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D、向Ba(OH)2溶液中加入足量的NaHCO3溶液:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |
已知碱能除去硝酸工业废气中的NO2和NO:NO2+NO+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.根据上述反应原理,下列气体中不能被过量的NaOH吸收的是( )
| A、1mol O2和4mol NO2 |
| B、1mol NO和4mol NO2 |
| C、1mol O2和4mol NO |
| D、1mol NO2和4mol NO |
设NA代表阿伏加德罗常数的数值.下列有关叙述一定正确的是( )
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、1 mol Na2O2所含阴离子数为2NA |
| C、含有lmol Fe(OH)3的氢氧化铁胶体中胶粒个数为NA |
| D、在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA |
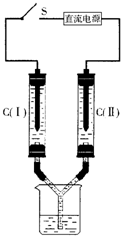 如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成.下列说法正确的是( )
如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成.下列说法正确的是( )| A、C(Ⅰ)电极产生可燃性气体 | ||||
| B、C(Ⅱ)的电极附近溶液呈碱性 | ||||
| C、C(Ⅱ) 电极产生的气体可使湿润的碘化钾淀粉试纸变蓝色 | ||||
D、电解过程中发生的化学方程式为:2NaCl
|