题目内容
有关AgCl的沉淀溶解平衡的说法正确的是( )
| A、AgCl难溶于水,溶液中没有Ag+和Cl- |
| B、AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C、向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D、向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、AgCl难溶于水,溶解度很小,但是不为零;
B、沉淀溶解平衡是动态平衡;
C、依据溶液中存在沉淀溶解平衡,加入氯离子影响平衡的移动分析;
D、沉淀转化为溶解度更小的物质容易发生.
B、沉淀溶解平衡是动态平衡;
C、依据溶液中存在沉淀溶解平衡,加入氯离子影响平衡的移动分析;
D、沉淀转化为溶解度更小的物质容易发生.
解答:
解:A、AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故A错误;
B、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故B正确;
C、向AgCl溶液中加入盐酸,若能导致氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,若盐酸浓度很小,导致氯离子浓度减小,就不会生成沉淀,故C错误;
D、沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色AgCl沉淀转化为淡黄色的AgBr沉淀,故D错误;
故选B.
B、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故B正确;
C、向AgCl溶液中加入盐酸,若能导致氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,若盐酸浓度很小,导致氯离子浓度减小,就不会生成沉淀,故C错误;
D、沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色AgCl沉淀转化为淡黄色的AgBr沉淀,故D错误;
故选B.
点评:本题主要考查了沉淀溶解平衡的影响因素和平衡移动方向,物质溶解度的变化应用,题目较简单,平时注意认真总结.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
化学与生产、生活和社会可持续发展密切相关.下列说法不正确的是( )
| A、二氧化硅可用于制造光导纤维 |
| B、小苏打可用于面粉发酵 |
| C、酒精可用作汽车燃料 |
| D、明矾可用于自来水杀菌消毒 |
下列有关化学用语的表示正确的是( )
A、NH4Cl的电子式: | ||
B、S的结构示意图: | ||
C、中子数为21的钾原子:
| ||
D、对硝基苯酚的结构简式: |
Se是人体必需的微量元素,下列关于
Se和
Se的说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
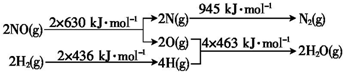 H2还原NO生成氮气和水蒸气的热化学方程式是
H2还原NO生成氮气和水蒸气的热化学方程式是