题目内容
4.已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是( )| A. | 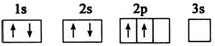 | B. | 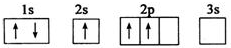 | ||
| C. | 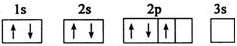 | D. | 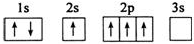 |
分析 A.1s、2s、2p能量升高,简并轨道中电子优先单独占据1个轨道,且自旋方向相同,能量最低;
B.2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道;
C.电子优先单独占据1个轨道;
D.2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道.
解答 解:A.能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低,故A正确;
B.2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,不符合能量最低原理,即应先填满2s再填2p,故B错误;
C.2p能级的3个简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子,不符合能量最低原理,原子处于能量较高的激发态,故C错误;
D.C.2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,即应先填满2s再填2p,不符合能量最低原理,原子处于能量较高的激发态,故D错误;
故选A.
点评 本题考查原子核外电子排布规律,题目难度不大,明确核外电子排布规律为解答关键,注意核外电子排布规律的理解与灵活运用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.下列各组物质中互为同系物的是( )
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH4与CH3CH2CH3 | D. | CH3CH2CH2CH3与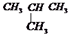 |
15.下列常见的物质电离和提纯操作中,将液体蒸发为气体再冷凝为液体的操作是( )
| A. | 结晶 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
12.下列说法错误的是( )
| A. | 有机物只能来自于有生命力的动、植物 | |
| B. | 德国化学家维勒首次用无机物氰酸铵合成了有机物尿素 | |
| C. | 德国化学李比希最先提出有机物的定量分析方法 | |
| D. | 荷兰化学家范特霍夫最先提出CH2Cl2没有同分异构体 |
9.某物质转化关系如图,有关说法不正确的是( )
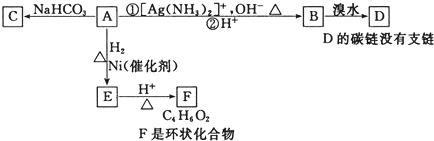

| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示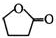 | |
| D. | 由B生成D发生加成反应 |
16.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变 | |
| B. | 降低温度,KW减小,pH不变 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低 |
6.提出元素周期律并绘制了第一个元素周期表的科学家是( )
| A. | 盖斯 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 道尔顿 |
 已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素 原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌. .
.