题目内容
7.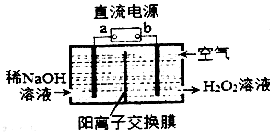 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:(1)a为正(正极、负极)
(2)通入空气的电极反应式为O2+2e-+2H2O=H2O2+2OH-.
分析 由题给信息可知,通入氧气在阴极还原得到H2O2,元素化合价降低,则b为负极,a为正极.
解答 解:(1)通入氧气在阴极还原得到H2O2,元素化合价降低,则a为正极,故答案为:正;
(2)通入空气的电极发生还原反应,电极反应式为O2+2e-+2H2O=H2O2+2OH-,故答案为:O2+2e-+2H2O=H2O2+2OH-.
点评 本题考查电解原理、得电子的一极发生还原反应,失去电子的一极发生氧化反应,根据元素化合价的变化情况进行判断正负极、阴阳极,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
20.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列有关说法中正确的是( )

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
16.X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是( )


| A. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 | |
| B. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| C. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| D. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
3.短周期元素X、Y、Z、W、Q的原子序数依次增大,X与Q同主族,X的最外层电子数是次外层电子数的2倍,W的最外层电子数等于其电子层数,Y与Z的核外电子数之和等于X与Q的核外电子数之和,下列说法正确的是( )
| A. | Z、W、Q、X、Y原子半径依次减小 | |
| B. | W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中 | |
| C. | Y与Q形成化合物在常温下一定为气态 | |
| D. | Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 |
12. 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
18.直接电解吸收是烟气脱硝的一种有效方法,用6%的稀硝酸吸收NOx会生成亚硝酸,再将吸收液导入电解槽使之转化为硝酸.电解装置如下:下列说法不正确的是( )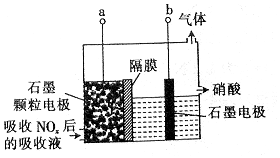

| A. | 吸收NOx的过程涉及氧化还原反应 | |
| B. | 石墨电极为颗粒状,可增大接触面积,提高电解效率 | |
| C. | 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值) | |
| D. | a极的电极反应式为HNO2-2e-+H2O═3H++NO3- |
15.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法正确的是( )


| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
 在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.
在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.