题目内容
18. 在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.
在容积为2L的密闭容器中,投入2molA和3molB发生反应:A(s)+2B(g)?2C(g),B的物质的量的变化如图所示.已知:2~t1时段的正反应速率比t2~t3时段的正反应速率快.(1)下列情况达到化学平衡状态的是AC
A、相同时间内消耗A与C的物质的量之比为1:2
B、B与C的浓度之比为1:1
C、容器内气体的质量不再发生变化
D、恒温下反应,容器内气体的压强不再变化
(2)开始到2min时,用B的浓度变化表示的反应速率为0.5mol/(L•min).
(3)t1~t2时平衡向逆(填“正”或“逆”)反应方向移动;升高温度该反应的化学平衡常数增大(填“增大”、“减小”或“无法判断”).
分析 (1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,据此判断;
(2)根据v=$\frac{△c}{△t}$进行计算;
(3)t1~t2时B的物质的量增加,说明平衡向逆反应方向移动;又因平衡逆向移动且2~t1时段的正反应速率比t2~t3时段的正反应速率快,说明逆反应是放热反应,则正反应是吸热反应,所以升高温度该反应的化学平衡常数增大;
解答 解:(1)A、相同时间内消耗A与C的物质的量之比为1:2,说明正逆反应速率相等,达平衡状态,故A正确;
B、B与C的浓度之比为1:1,不能说明浓度不变,故B错误;
C、容器内气体的质量不再发生变化,说明正逆反应速率相等,反应达平衡状态,故C正确;
D、两边气体计量数相等,恒温下反应,容器内气体的压强始终不再变化,故D错误;
故选AC;
(2)v(B)=$\frac{△c}{△t}$=$\frac{\frac{3-1}{2}}{2}$=0.5mol/(L•min),故答案为:0.5mol/(L•min);
(3)t1~t2时B的物质的量增加,说明平衡向逆反应方向移动;又因平衡逆向移动且2~t1时段的正反应速率比t2~t3时段的正反应速率快,说明逆反应是放热反应,则正反应是吸热反应,所以升高温度该反应的化学平衡常数增大,故答案为:逆;增大.
点评 本题考查了平衡状态的判断,反应速率的计算,外界条件对平衡的影响,平衡常数的影响,涉及的知识点较多,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-) | |
| B. | 25℃时,0.1mol•L-1醋酸溶液PH=a,0.01mol•L-1醋酸溶液PH=b,则b=a+1 | |
| C. |  常温下,图表示以酚酞作指示剂,用0.1mol•L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性 | |
| D. | 向0.1mol•L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
9.化学与生产、生活、社会等密切相关,下列说法正确的是( )
| A. | 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂,也可以通过分馏提取得到汽油 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | NH4HCO3受热能分解产生气体,在食品工业中可作为焙制糕点的膨松剂 |
6.对下列现象或事实的化学解释不正确的是( )
| 选项 | 现象或事实 | 化学解释 |
| A | 节日焰火五彩缤纷 | 金属化合物的焰色反应 |
| B | 工业上通过煤的干馏制备焦炭 | 煤的干馏是物理过程 |
| C | 用热的纯碱溶液洗去油污 | Na2CO3溶于水显碱性 |
| D | 用浸泡过高锰酸钾溶液的硅土保鲜水果 | 乙烯被酸性高锰酸钾氧化 |
| A. | A | B. | B | C. | C | D. | D |
13.下列现象不适宜用勒夏特列原理解释的是( )
| A. | 工业上用Na2CO3溶液浸泡水垢 | B. | 夏天的食物更易腐败变质 | ||
| C. | 将氨水保存在温度较低处 | D. | 热的纯碱溶液去除油污效果更好 |
4.镍氢电池(NiMH)目前己经成为混合动力汽车的一种主要电池类型.NiMH中的M 示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH 下列说法正确的是( )
| A. | 放电过程中,正极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时,电子由负极→正极→电解质溶液→负极,形成闭合回路 | |
| C. | 充电时,阴极附近溶液pH 降低 | |
| D. | 充电过程中,OH-从阳极向阴极迁移 |
11.下列表示正确的是( )
| A. | 氯化钠的分子式:NaCl | B. | 乙醇的结构式:C2H5OH | ||
| C. | 水分子的比例模型: | D. | Mg2+结构示意图: |
8.短周期主族元素W、X、Y、Z的原子序数依次增大,W2-和X+的电子层结构相同,X的原子半径是短周期主族元素原子中最大的,W与Y同族.下列说法正确的是( )
| A. | W、X形成的化合物只含有离子键 | B. | 原子半径:Y>Z>W | ||
| C. | 还原性:W2->Y2- | D. | 氧化物的水化物酸性:Y<Z |
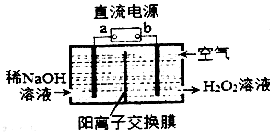 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示: