题目内容
1.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24LCl2发生反应转移的电子数一定为0.2NA | |
| B. | 标准状况下,11.2L三氧化硫晶体含有的分子数为0.5NA | |
| C. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| D. | 1L0.1mol/L的氨水中含OH-离子数为0.1NA |
分析 A.氯气和水的反应为可逆反应;
B.标准状况下三氧化硫不是气体;
C.3.36L氧气的物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.2g硫物质的量=$\frac{3.2g}{32g/mol}$=0.1mol,氧气过量;
D.1L0.1mol•L-1的氨水中含有溶质一水合氨0.1mol,一水合氨为弱电解质,电离的氢氧根离子的物质的量小于0.1mol.
解答 解:A.氯气和水的反应为可逆反应,不能完全反应,故转移的电子数小于0.1NA个,故A错误;
B.气体摩尔体积为22.4L/mol,标准状况下,11.2L三氧化硫晶体物质的量不是0.5mol,故B错误;
C.3.36L氧气的物质的量为0.15mol,3.2g硫的物质的量为0.1mol,可生成SO2分子数为0.1NA,故C正确;
D.一水合氨为弱电解质,在溶液中只能部分电离出氢氧根离子,所以溶液中氢氧根离子的物质的量小于0.1mol,含有的OH-离子数小于0.1NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
11.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如表:
下列判断不正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=$\frac{{K}_{W}}{1×1{0}^{-5}}$mol•L-1 | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
6.下列叙述正确的是( )
| A. | 7.1gCl2与足量NaOH溶液反应转移0.2×6.02×1023个电子 | |
| B. | 1mol羟基中含有的电子数目为9×6.02×1023个 | |
| C. | 标准状况下,2.24L辛烷含有0.8×6.02×1023个碳原子 | |
| D. | 1L 0.50mol/L Na2CO3溶液中含有1.5×6.02×1023个离子 |
13.下列叙述的两个量,一定相等的是( )
| A. | 0.1mol•L-1NaNO3与0.05mol•L-1Na2CO3溶液中的Na+离子数目 | |
| B. | 质量相等的石墨和C60中的碳原子数目 | |
| C. | 标准状况下等体积的SO2与SO3的分子数目 | |
| D. | pH都为3的稀盐酸与AlCl3溶液中,由水电离产生的H+离子数目 |


 +
+ $\stackrel{H+}{→}$
$\stackrel{H+}{→}$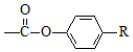 +HOR′
+HOR′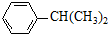 .
.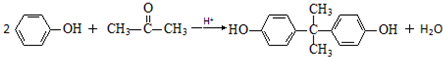 .
.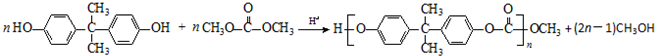 .
.