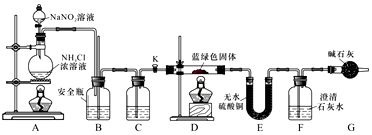
题目内容
6.下列叙述正确的是( )| A. | 7.1gCl2与足量NaOH溶液反应转移0.2×6.02×1023个电子 | |
| B. | 1mol羟基中含有的电子数目为9×6.02×1023个 | |
| C. | 标准状况下,2.24L辛烷含有0.8×6.02×1023个碳原子 | |
| D. | 1L 0.50mol/L Na2CO3溶液中含有1.5×6.02×1023个离子 |
分析 A.氯气和氢氧化钠溶液反应时,有一半的氯气作氧化剂,一半的氯气作还原剂,根据氧化剂或还原剂的量确定转移电子数;
B.羟基为中性原子团含9个电子;
C.标准状况下气体摩尔体积为22.4L/mol;
D.溶液中碳酸根离子水解离子数增多.
解答 解:A.氯气和氢氧化钠溶液反应时,有一半的氯气作氧化剂,一半的氯气作还原剂,则7.1 g Cl2与足量NaOH溶液反应转移电子=$\frac{7.1g}{71g/mol}$×6.02×1023=0.1×6.02×1023,故A错误;
B.羟基为中性原子团含9个电子,1mol羟基中含有的电子数目为9×6.02×1023个,故B正确;
C.辛烷标准状况下不是气体,2.24L辛烷物质的量不是0.1mol,故C错误;
D.1L 0.50mol/L Na2CO3溶液中碳酸钠物质的量为0.5mol,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,含有离子数大于1.5×6.02×1023个离子,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的计算应用,主要是微粒结构、微粒数计算、气体摩尔体积的条件应用等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
16.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 向含有FeI2的溶液中通入适量氯气,当有1mo1Fe2+被氧化时,该反应转移电子数目为3NA | |
| B. | 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5NA | |
| C. | 含0.1mo1NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| D. | C3H8分子中的2个H原子分别被1个-NH2和一个-OH取代,1mol此有机物所含共用电子对数目为13NA |
14.现有三组溶液:①汽油和四氯化碳混合溶液 ②植物油和水③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
1.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCl2发生反应转移的电子数一定为0.2NA | |
| B. | 标准状况下,11.2L三氧化硫晶体含有的分子数为0.5NA | |
| C. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| D. | 1L0.1mol/L的氨水中含OH-离子数为0.1NA |
11.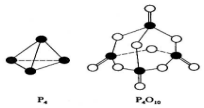 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |


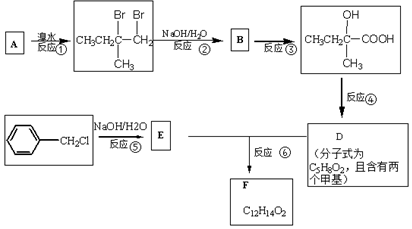
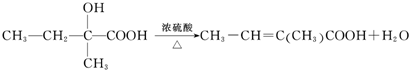 .
. .
. .
.