题目内容
6. 阅读下列信息,完成下列各题
阅读下列信息,完成下列各题(1)次磷酸(H3PO2)是一种精细化工产品,H3PO2是一元弱酸,写出其电离方程式:H3PO2?H++H2PO2-.
(2)某温度下纯水中C(H+)=2×10-7 mol/L,则此时溶液中的C(OH-)=2×10-7mol/L此温度下,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-)=8×10-9 mol/L
(3)已知t℃时,Kw=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液为中性,则 $\frac{a}{b}$=10:1.若所得混合溶液的pH=2,则 $\frac{a}{b}$=9:2.
(4)在常温下,将pH=2的盐酸溶液甲和pH=2的醋酸溶液乙取等体积各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
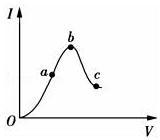
(5)在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.
①a、b、c三点对应的溶液中,C(H+)最大的是b.(填字母,后同)
②a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是c.
分析 (1)H3PO2弱电解质部分电离,用可逆号;
(2)纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度;
(3)升高温度,促进水的电离,Kw越大,温度越大;在t℃时,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液为中性,氢离子和氢氧根离子物质的量相同,若所得混合溶液的pH=2,则硫酸过量,利用剩余氢离子的浓度计算pH;
(4)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离;
pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积、等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大;
(5)①导电能力越强,离子浓度越大,氢离子浓度越大;
②溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;
解答 解:(1)H3PO2是一元弱酸,部分电离,用可逆号,电离方程式为:H3PO2?H++H2PO2-;
故答案为:H3PO2?H++H2PO2-;
(2)某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=2×10-7mol/L;若温度不变,滴入稀盐酸,使C(H+)=5×10-6mol/L,溶液中则溶液中C(H+)C(OH-)=10-14;
C(OH-)=8×10-9mol/L,
故答案为:2×10-7 ;8×10-9;
(3)t℃,KW=1×10-13>1×10-14,促进了水的电离,则t℃>25℃,
t℃时,将pH=11的NaOH溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-13}}{1×1{0}^{-11}}$mol/L=0.01mol/L,
pH=1的H2SO4的溶液中氢离子浓度为:0.1mol/L,
若所得混合溶液为中性,0.1mol/L×bL=0.01mol/L×aL,得到a:b=10:1,
所得混合溶液的pH=2,则混合液中氢离子浓度为0.01mol/L,
则:$\frac{bL×0.1mol/L-aL×0.01mol/L}{aL+bL}$=0.01mol/L,
解得:a:b=9:2,
故答案为:10:1; 9:2;
(4)氯化氢是强电解质,完全电离,稀释100倍后pH增大2个单位.醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,导致醋酸溶液稀释100倍后pH增大不到2个单位,所以盐酸的pH大于醋酸,pH(甲)>pH(乙),pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,等体积、等pH的两种酸,醋酸的物质的量大于盐酸,酸的物质的量越多需要等浓度的氢氧化钠溶液体积越大,所以V(甲)<V(乙),
故答案为:>;<;
(5)①由于导电能力越强,溶液中离子浓度越大,氢离子浓度越大,C(H+)c<a<b,最大的是b,
故答案为:b;
②溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度的是c,
故答案为:c.
点评 本题考查弱酸的电离、溶液pH的计算,为高频考点,加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,侧重于学生的分析能力和计算能力的考查,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,题目难度中等.

| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | NaHCO3 |
①第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
②第Ⅱ组物质中,跟第Ⅰ组所有物质都不能发生反应的是NaOH,该物质能与第Ⅲ组中所有物质发生反应,其离子反应方程式分别为:Cu2++2OH-=Cu(OH)2↓,OH-+H+=H2O,OH-+HCO3-=CO32-+H2O.
( 2)现有下列几种物质
①铜 ②稀硫酸 ③氯化氢 ④氯气 ⑤空气 ⑥二氧化碳 ⑦盐酸 ⑧氯化钠 ⑨熔融的硝酸钾 ⑩硫酸钡
其中,属于混合物的有②⑤⑦,( 填序号,下同)属于电解质的有③⑧⑨⑩,属于非电解质的有⑥.
①假说法 ②实验法 ③分类法 ④比较法.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①②③④ |
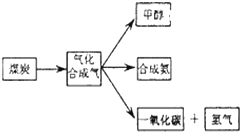
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
| A. | $\overline{v}$(O2)=0.3 mol•L-1•s-1 | B. | $\overline{v}$(NO)=0.24mol•L-1•s-1 | ||
| C. | $\overline{v}$(NH3)=0.12 mol•L-1•s-1 | D. | $\overline{v}$(H2O)=0.36mol•L-1•min-1 |
| A. | 将 100mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | 通常状况下,0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| C. | 常温常压下,2.4g金属镁变成镁离子时,失去的电子数为0.1NA | |
| D. | 标准状况下,22.4L由N2和N2O组成的混合气体中,所含N原子的个数为2NA |