题目内容
4. 欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.
欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.(1)写出如图仪器A的名称250mL容量瓶,使用此仪器A前应检查它是否漏水.
(2)称取NaOH固体前,应先在托盘天平的左盘上放一个小烧杯称量其质量,然后称取1.0gNaOH.
(3)转移溶液时,应将已冷却的NaOH溶液沿玻璃棒 注入仪器A中.当A中的液面接近刻度1-2cm处,改用胶头滴管加水至标线.
(4)若出现下列操作时,对所配溶液将有何影响(填“偏高、偏低、无影响”)
(a)若称量前NaOH已部分潮解偏低;
(b)不将洗涤液转移入仪器A就定容偏低;
(c)定容时,仰视仪器A刻度线偏低.
分析 (1)熟悉仪器构造说出其名称;依据容量瓶构造及使用注意事项解答;
(2)依据托盘天平使用方法结合氢氧化钠具有腐蚀性的特点解答,依据m=CVM计算溶质的质量;
(3)依据移液和定容的正确操作解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)如图仪器A的名称250mL容量瓶;容量瓶带有瓶塞,使用前应检查是否漏水;
故答案为:250mL容量瓶;漏水;
(2)托盘天平使用遵循:左物右码的原则,药品应放在左盘;氢氧化钠为腐蚀性药品,应放在小烧杯中称量;配制250mL0.1mol/L的NaOH溶液,应称取溶质氢氧化钠的质量m=0.25L×0.1mol/L×40g/mol=1.0g;
故答案为:左;小烧杯;1.0;
(3)转移溶液时,应将已冷却的NaOH溶液沿玻璃棒注入容量瓶,当A中的液面接近刻度1-2cm处,改用胶头滴管加水至标线;
故答案为:玻璃棒;胶头滴管;
(4)(a)若称量前NaOH已部分潮解,导致称取的固体中含有氢氧化钠的物质的量偏小,溶液浓度偏低;
(b)不将洗涤液转移入仪器A就定容,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
(c)定容时,仰视仪器A刻度线,导致溶液体积偏大,溶液浓偏低;
故答案为:偏低;偏低;偏低.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和配制步骤是解题关键,注意容量瓶规格的选择和误差分析方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
15.某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )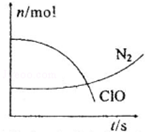

| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
12.下列有关化学反应速率的说法中,正确的是( )
| A. | 100mL 2mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是放热反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以反应生成N2和CO2,在排气管中加催化剂可减小空气污染 |
19. 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
9.下列各项中不涉及化学反应的是( )
| A. | 用明矾净水 | B. | 工业上生产生石灰 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
16.下列有关溶液(室温下)的说法正确的是( )
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |