题目内容
1.对实验现象的观察与分析有助于获得化学知识并学会科学探究的方法.下列对实验现象的分析合理的是( )
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
分析 根据实验的现象来分析出现这一现象的原因,并注意离子之间的相互影响来作出合理的判断.
A、无色溶液中滴入石蕊试液后溶液呈蓝色,根据酚酞的变色范围可知,该溶液显碱性;
B、无色溶液中滴入硝酸银溶液,产生白色沉淀,沉淀可能为氯化银,也可能是碳酸银等;
C、使湿润红色石蕊试纸变蓝的气体为氨气;
D、向某固体中加入稀盐酸产生气泡,气体可以是二氧化碳或是二氧化硫.
解答 解:A、无色溶液中滴入石蕊试液后溶液呈蓝色,根据酚酞的变色范围可知,该溶液显碱性,但不一定是碱溶液,如碳酸钠溶液属于盐溶液也可使酚酞变红,故A错误;
B、无色溶液中滴入硝酸银溶液,产生白色沉淀,沉淀可能为氯化银,也可能是碳酸银等,则溶液可能为盐酸或碳酸钠溶液等,故B错误;
C、使湿润红色石蕊试纸变蓝的气体为氨气,则白色固体与熟石灰共热生成氨气,即白色固体为铵盐,故C正确;
D、向某固体中加入稀盐酸产生气泡,气体可以是二氧化碳或是二氧化硫,证明该固体可能是碳酸盐、碳酸氢盐、亚硫酸盐等,故D错误.
故选C.
点评 本题考查了常见离子及常见物质的检验,学生应明确物质的性质、明确出现现象的原因,能用具体的实例来分析解决问题.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
15.某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )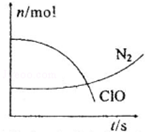

| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
16.下列有关溶液(室温下)的说法正确的是( )
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
16.实验室用高锰酸钾固体配制0.10mol/L的高锰酸钾溶液500mL,并用该标准液滴定某酸性工业废水中铁元素的含量,请按要求完成实验,并回答相关问题:
I.标准液的配制
(1)所需的实验仪器有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500mL容量瓶和胶头滴管.
(2)称量所需高锰酸钾固体7.9g,用少量蒸馏水溶解于烧杯中,搅拌,待冷却至室温,转移至容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液也要注入容量中,并摇匀.
(3)若定容时,俯视观察液面,造成所配高锰酸钾溶液浓度偏高(填“偏高”、“偏低”、“不影响”).
II.滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
(4)在滴定时,每次准确量取待测液25.00ml于锥形瓶中,并加入适量酸酸化后进行滴定,你认为可以加入下面哪种酸C
A.盐酸 B.硝酸 C.硫酸
(5)已知亚铁离子与高锰酸根按照物质的量之比5:1反应,写出酸性条件下滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(6)重复三次滴定,结果记录如下表:计算该工业废水中亚铁离子的浓度为0.2mol/L
I.标准液的配制
(1)所需的实验仪器有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500mL容量瓶和胶头滴管.
(2)称量所需高锰酸钾固体7.9g,用少量蒸馏水溶解于烧杯中,搅拌,待冷却至室温,转移至容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液也要注入容量中,并摇匀.
(3)若定容时,俯视观察液面,造成所配高锰酸钾溶液浓度偏高(填“偏高”、“偏低”、“不影响”).
II.滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
(4)在滴定时,每次准确量取待测液25.00ml于锥形瓶中,并加入适量酸酸化后进行滴定,你认为可以加入下面哪种酸C
A.盐酸 B.硝酸 C.硫酸
(5)已知亚铁离子与高锰酸根按照物质的量之比5:1反应,写出酸性条件下滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(6)重复三次滴定,结果记录如下表:计算该工业废水中亚铁离子的浓度为0.2mol/L
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
6.化学在文物的保护和鉴定方面发挥着重要的作用.已知氨水能够清洗壁画表面的污垢,醋酸可以固色.某文物保护单位现用500mL容量瓶配制0.1mol•L-1的氨水,以下操作正确的是( )
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
13. 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:
CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H回答下列问题:
(1)已知键能数值如下:
则△H=+124kJ.mol-1;若乙烷、乙烯的燃烧热分别为1559.8kJ-mol-l、1411kJ-mol-l,则代表H2燃烧热的热化学反应方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-272.8kJ.mol-1.
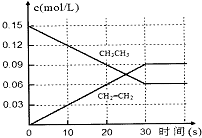
(2)T℃下,在2L的恒容密闭容器中充入一定量的CH3CH3,各物质的浓度随时间变化如图:
①0-30s,v(H2)=0.003mol/(L•s),反应的平衡常数K0.135mol/L.
②升高温度,平衡常数K增大(填“增大”“减小”“不变”),理由是该反应为吸热反应,升高温度,平衡正向移动,K增大
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,则达平衡后CH3CH3转化率<60%(填“>”“<”“=”),理由是T℃,在2L容器中充入0.3molCH3CH3的转化率为60%,若充入的是0.6molCH3CH3,即相当于在原0.3molCH3CH3的基础上再增加了0.3molCH3CH3,相当于增压,CH3CH3转化率降低.
 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H回答下列问题:
(1)已知键能数值如下:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
(2)T℃下,在2L的恒容密闭容器中充入一定量的CH3CH3,各物质的浓度随时间变化如图:
①0-30s,v(H2)=0.003mol/(L•s),反应的平衡常数K0.135mol/L.
②升高温度,平衡常数K增大(填“增大”“减小”“不变”),理由是该反应为吸热反应,升高温度,平衡正向移动,K增大
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,则达平衡后CH3CH3转化率<60%(填“>”“<”“=”),理由是T℃,在2L容器中充入0.3molCH3CH3的转化率为60%,若充入的是0.6molCH3CH3,即相当于在原0.3molCH3CH3的基础上再增加了0.3molCH3CH3,相当于增压,CH3CH3转化率降低.
11.根据相应的图象,判断下列相关说法正确的是( )


| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |