题目内容
11. 短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )| A. | Y、Z元素形成的化合物中可能含有共价键 | |
| B. | 原子半径;Y<Z<W | |
| C. | 常温下s溶液的pH<7 | |
| D. | s与过量盐酸反应只生成一种正盐 |
分析 m是由其中两种元素组成的二元化合物,m电解生成n和s,n是元素W的单质,且其氧化物具有两性,则W为Al元素,n为金属铝;常温下0.1mol•L-1 q溶液的pH为13是,则q为一元强碱溶液,q能够与金属Al(n)反应,则q为NaOH溶液,故X为H、Y为O、Z为Na元素;n与q溶液反应生成s,s是由这些元素组成的三元化合物,则s为NaAlO2溶液;m是由其中两种元素组成的二元化合物,且含有Al元素,则m为Al2O3,据此结合元素周期律知识解答.
解答 解:m是由其中两种元素组成的二元化合物,m电解生成n和s,n是元素W的单质,且其氧化物具有两性,则W为Al元素,n为金属铝;常温下0.1mol•L-1 q溶液的pH为13是,则q为一元强碱溶液,q能够与金属Al(n)反应,则q为NaOH溶液,故X为H、Y为O、Z为Na元素;n与q溶液反应生成s,s是由这些元素组成的三元化合物,则s为NaAlO2溶液;m是由其中两种元素组成的二元化合物,且含有Al元素,则m为Al2O3,
A.Y、Z分别为O、Na元素,二者形成的化合物有氧化钠和过氧化钠,其中过氧化钠中含有共价键,故A正确;
B.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小:O<Al<Na,即Y<W<Z,故B错误;
C.s为NaAlO2溶液,偏铝酸根离子水解,溶液呈碱性,pH>7,故C错误;
D.s为NaAlO2溶液,偏铝酸钠与盐酸反应生成氯化铝和氯化钠两种正盐,故D错误;
故选A.
点评 本题考查了无机推断,题目难度中等,正确推断各物质名称为解答关键,注意熟练掌握铝及其化合物性质,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
16.下列有关同分异构体数目的叙述不正确的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与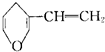 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 | |
| D. | 菲的结构简式为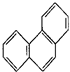 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
1.下列反应的离子方程式书写正确的是( )
| A. | 实验室用大理石和稀盐酸抽取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 氢氧化铝与盐酸反应:H++OH-═H2O | |
| C. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+2H++NO |
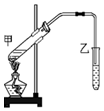 某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空:
某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空: