题目内容
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.
I.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
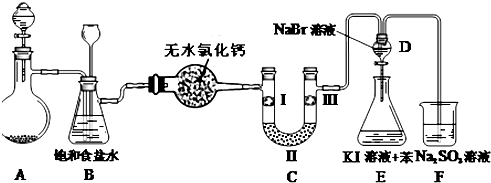
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相关的化学反应方程式为: .
(2)装置B是安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 .(选a或b或c)
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .该现象不能说明溴的非金属性强于碘,原因是 .
(5)①如果向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.该反应的离子方程式为 ,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.该反应的离子方程式为 .
②把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 .
(6)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一.
①写出该反应的化学方程式: .
②在该反应中,氧化剂是 ,被氧化的元素是 .
③在反应中,每转移1mol电子,消耗HCl mol.
I.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相关的化学反应方程式为:
(2)装置B是安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入
| a | b | c | |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)①如果向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.该反应的离子方程式为
②把KI换成KBr,则CCl4层变为
(6)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一.
①写出该反应的化学方程式:
②在该反应中,氧化剂是
③在反应中,每转移1mol电子,消耗HCl
考点:氯气的实验室制法,离子方程式的书写,氧化还原反应,氯、溴、碘的性质实验
专题:实验题,元素及其化合物
分析:(1)高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水;
(2)C中若发生堵塞,则B中锥形瓶内压强增大,长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘;
(5)①氯水中的氯气能够氧化碘离子生成碘,碘与到四氯化碳变紫色,氯气能够氧化碘生成碘酸钾;
②氯水中的氯气能够氧化溴离子,溴溶于四氯化碳县橙色;
氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性;
(6)①根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,再根据质量守恒、电子守恒书写方程式;
②氧化剂得电子被还原;化合价升高的元素被氧化;
③由方程式可知As元素由H3AsO3中+3价,降低为As中0价,每2mol反应H3AsO3时,需要消耗HCl6mol,即转移6mol电子消耗12molHCl.
(2)C中若发生堵塞,则B中锥形瓶内压强增大,长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘;
(5)①氯水中的氯气能够氧化碘离子生成碘,碘与到四氯化碳变紫色,氯气能够氧化碘生成碘酸钾;
②氯水中的氯气能够氧化溴离子,溴溶于四氯化碳县橙色;
氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性;
(6)①根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,再根据质量守恒、电子守恒书写方程式;
②氧化剂得电子被还原;化合价升高的元素被氧化;
③由方程式可知As元素由H3AsO3中+3价,降低为As中0价,每2mol反应H3AsO3时,需要消耗HCl6mol,即转移6mol电子消耗12molHCl.
解答:
解:(1)高锰酸钾与浓盐酸反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O;
故答案为:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O;
(2)C中若发生堵塞,生成的氯气使锥形瓶中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱;
故答案为:锥形瓶中液面下降,长颈漏斗中液面上升;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有c符合,故答案为:c;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,该现象不能说明溴的非金属性强于碘,过量的氯气也可将碘离子氧化,应排除氯气的干扰;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;过量的Cl2也可将I-氧化为I2;
(5)①氯气与碘化钾反应的离子方程式为:Cl2+2I-=I2+2Cl-;
氯气与碘反应的离子方程式:5Cl2+I2+6H2O=2IO3-+12H++10Cl-;
故答案为:Cl2+2I-=I2+2Cl-;5Cl2+I2+6H2O=2IO3-+12H++10Cl-;
②氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为棕色,继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,
则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3;
故答案为:棕;HBrO3>Cl2>HIO3;
(6)①As是反应物之一,根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,所以反应方程式为12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O;
故答案为:12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O;
②根据As、Sn元素化合价可知,H3AsO3是氧化剂,被还原为As,+2的Sn化合价升高为+4被氧化;
故答案为:H3AsO3;Sn;
③由方程式可知As元素由H3AsO3中+3价,降低为As中0价,每2mol反应H3AsO3时,需要消耗HCl6mol,即转移6mol电子消耗12molHCl,所以每转移1mol电子,消耗HCl2mol;
故答案为:2.
故答案为:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O;
(2)C中若发生堵塞,生成的氯气使锥形瓶中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱;
故答案为:锥形瓶中液面下降,长颈漏斗中液面上升;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有c符合,故答案为:c;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,该现象不能说明溴的非金属性强于碘,过量的氯气也可将碘离子氧化,应排除氯气的干扰;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;过量的Cl2也可将I-氧化为I2;
(5)①氯气与碘化钾反应的离子方程式为:Cl2+2I-=I2+2Cl-;
氯气与碘反应的离子方程式:5Cl2+I2+6H2O=2IO3-+12H++10Cl-;
故答案为:Cl2+2I-=I2+2Cl-;5Cl2+I2+6H2O=2IO3-+12H++10Cl-;
②氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为棕色,继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,
则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3;
故答案为:棕;HBrO3>Cl2>HIO3;
(6)①As是反应物之一,根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,所以反应方程式为12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O;
故答案为:12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O;
②根据As、Sn元素化合价可知,H3AsO3是氧化剂,被还原为As,+2的Sn化合价升高为+4被氧化;
故答案为:H3AsO3;Sn;
③由方程式可知As元素由H3AsO3中+3价,降低为As中0价,每2mol反应H3AsO3时,需要消耗HCl6mol,即转移6mol电子消耗12molHCl,所以每转移1mol电子,消耗HCl2mol;
故答案为:2.
点评:本题以氯气的制备为载体考查了氯气的性质,氧化还原反应方程式的书写,题目难度中等,解题时注意把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
下列叙述错误的是( )
| A、纤维素的水解实验操作为:把一小团棉花放入试管中,加入几滴90%的硫酸溶液,用玻璃棒把棉花捣成糊状,小火微热,至成亮棕色溶液 |
| B、向油脂发生皂化反应后所得的混合溶液中加入固体NaCl会出现分层现象,此分层过程发生的主要是物理变化 |
| C、只用滴管、试管和水就能鉴别乙二醇、溴代烃、乙醛 |
| D、已知苯与苯酚的沸点差异较大,故一定能用蒸馏的方法分离苯与苯酚的混合液 |
下列化常用语中,正确的是( )
| A、两个氧分子-O2 |
| B、氢氧化铁的化学式-Fe(OH)3 |
| C、CO2中氧元素的化合价为+2价 |
| D、水通电得到氧气的化学方程式是2H2O=O2↑+2H2↑ |
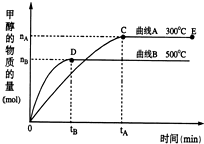 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
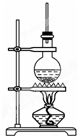 如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下: