题目内容
科学实验和人类的生活经验告诉我们,化学反应中的物质变化和能量变化是紧密地联系在一起的.请回答以下问题:
(1)离子反应H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1表示在稀溶液中,强酸和强碱反应生成1molH2O(1),这时的反应热叫做中和热.在中和热的测定实验中,下列溶液组合最合适的是 .
A.25mL0.4mol?L-1盐酸溶液与25mL0.4mol?L-1氨水
B.25mL0.4mol?L-1盐酸溶液与25mL0.45mol?L-1NaOH溶液
C.25mL0.4mol?L-1H2SO4溶液与25mL0.8mol?L-1NaOH溶液
D.25mL0.4mol?L-1H2SO4溶液与25mL0.45mol?L-1NaOH溶液
(2)写出稀H2SO4溶液与稀NaOH溶液发生反应,表示中和热的热化学方程式:
(3)已知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1当1molCH4(g)与2molO2(g)的总能量之和是3048kJ,则1molCO2(g)与2molH2O(l)的总能量之和是 kJ.
(1)离子反应H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1表示在稀溶液中,强酸和强碱反应生成1molH2O(1),这时的反应热叫做中和热.在中和热的测定实验中,下列溶液组合最合适的是
A.25mL0.4mol?L-1盐酸溶液与25mL0.4mol?L-1氨水
B.25mL0.4mol?L-1盐酸溶液与25mL0.45mol?L-1NaOH溶液
C.25mL0.4mol?L-1H2SO4溶液与25mL0.8mol?L-1NaOH溶液
D.25mL0.4mol?L-1H2SO4溶液与25mL0.45mol?L-1NaOH溶液
(2)写出稀H2SO4溶液与稀NaOH溶液发生反应,表示中和热的热化学方程式:
(3)已知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1当1molCH4(g)与2molO2(g)的总能量之和是3048kJ,则1molCO2(g)与2molH2O(l)的总能量之和是
考点:反应热和焓变,中和热,热化学方程式
专题:化学反应中的能量变化
分析:(1)弱酸或弱碱的电离吸热,会导致测得反应热的数值偏小;盐酸和氢氧化钠溶液的用量只要满足氢氧化钠溶液稍过量,保证氢离子完全反应;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据△H=生成物的总能量-反应物的总能量计算.
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据△H=生成物的总能量-反应物的总能量计算.
解答:
解:(1)A、氨水电离过程需要吸热,会导致测得反应热的数值偏小,故A不合适;
B、盐酸提供的氢离子为0.010mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,碱稍过量,故B合适;
C、硫酸溶液提供的氢离子与氢氧化钠溶液提供的氢氧根离子的物质的量相等,不能保证氢离子完全反应,故C不合适;
D、硫酸溶液提供的氢离子为0.020mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,氢离子不能完全反应,故D不合适;
故答案为:B;
(2)由H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1可知:H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(3)1molCO2(g)与2molH2O(l)的总能量之和=-890kJ+3048kJ=2158kJ,
故答案为:2158.
B、盐酸提供的氢离子为0.010mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,碱稍过量,故B合适;
C、硫酸溶液提供的氢离子与氢氧化钠溶液提供的氢氧根离子的物质的量相等,不能保证氢离子完全反应,故C不合适;
D、硫酸溶液提供的氢离子为0.020mol,氢氧化钠溶液提供的氢氧根离子为0.01125mol,氢离子不能完全反应,故D不合适;
故答案为:B;
(2)由H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1可知:H2SO4和NaOH反应的中和热是指反应生成1mol水放出57.3kJ的热量,
反应的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)1molCO2(g)与2molH2O(l)的总能量之和=-890kJ+3048kJ=2158kJ,
故答案为:2158.
点评:本题考查了中和热的测定、中和热热化学方程的书写以及焓变的计算,题目难度不大,注意中和热测定实验中一般要求氢氧化钠溶液稍过量,因为在实验条件下,盐酸比氢氧化钠溶液稳定.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
完全相同的两个密闭容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2、O2各2克,在同一温度下反应,2SO2(g)+O2(g)?2SO3(g)达平衡后,甲中SO2的转化率为a%,乙中SO2的转化率为b%,则( )
| A、a%>b% | B、a%<b% |
| C、a%=b% | D、无法判定 |
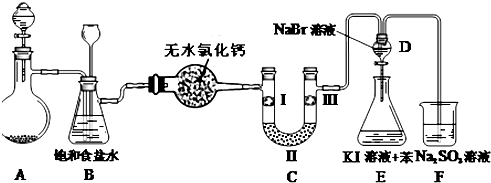
 (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.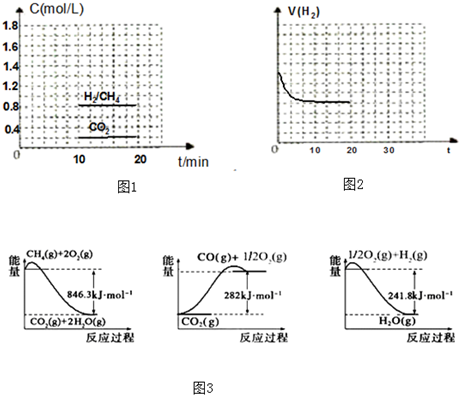
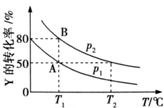 在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.
在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.