题目内容
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.
(1)氮、氧元素非金属性较强的是 .
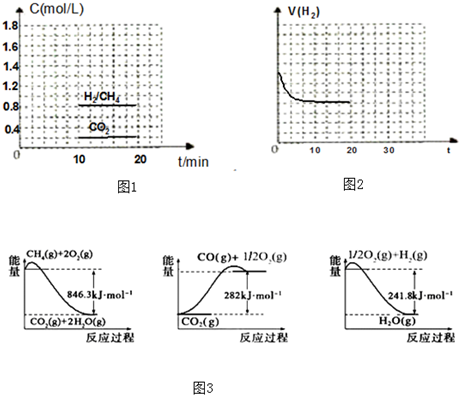
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图1可知SCR技术中的氧化剂为 .
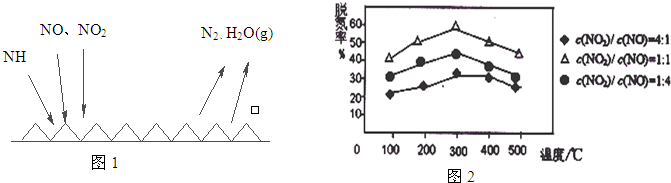
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= .当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 .
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-.海水的pH会 (填“升高”、“不变”或“降低”).
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 .
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一.工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是 .
(1)氮、氧元素非金属性较强的是
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图1可知SCR技术中的氧化剂为
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-.海水的pH会
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一.工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是

考点:氮的氧化物的性质及其对环境的影响,常见的生活环境的污染及治理
专题:元素及其化合物
分析:(1)根据元素周期表中的规律知识来回答;
(2)①得电子化合价降低的反应物是氧化剂;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(3)①SO32-可以被海水中的溶解氧氧化为SO42-,酸性增强;
②SO2和O2在H2SO4溶液中可以构成原电池,负极上二氧化硫失去电子.
(4)根据信息内容书写化学方程式并进行配平.
(2)①得电子化合价降低的反应物是氧化剂;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(3)①SO32-可以被海水中的溶解氧氧化为SO42-,酸性增强;
②SO2和O2在H2SO4溶液中可以构成原电池,负极上二氧化硫失去电子.
(4)根据信息内容书写化学方程式并进行配平.
解答:
解:(1)同周期元素的原子的得电子能力(元素的非金属性)从左到右逐渐增强,氮、氧元素非金属性较强的是氧,故答案为:氧;
(2)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2,故答案为:NO、NO2;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(3)①SO32-可以被海水中的溶解氧氧化为SO42-,由亚硫酸变为硫酸,酸性增强,则海水pH降低,故答案为:降低;
②SO2和O2在H2SO4溶液中可以构成原电池,负极上二氧化硫失去电子,负极反应式为SO2-2e-+2H2O═SO42-+4H+,故答案为:SO2-2e-+2H2O═SO42-+4H+.
(4)工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,其方程式为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4,故答案为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4.
(2)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2,故答案为:NO、NO2;
②根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(3)①SO32-可以被海水中的溶解氧氧化为SO42-,由亚硫酸变为硫酸,酸性增强,则海水pH降低,故答案为:降低;
②SO2和O2在H2SO4溶液中可以构成原电池,负极上二氧化硫失去电子,负极反应式为SO2-2e-+2H2O═SO42-+4H+,故答案为:SO2-2e-+2H2O═SO42-+4H+.
(4)工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,其方程式为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4,故答案为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4.
点评:本题考查较综合,涉及图象分析、热化学、电化学知识等,注意图象分析中的曲线的变化趋势,题目难度中等.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是( )
| A、加热 |
| B、不用稀硫酸,改用98%浓硫酸 |
| C、加水稀释硫酸 |
| D、不用铁片,改用铁粉 |
下列的叙述中正确的是( )
| A、构成原电池的正极和负极的材料必须是两种活泼性不同的金属 |
| B、原电池是把化学能转变为电能的装置 |
| C、把铜片插入FeCl3溶液中,在铜片表面出现一层铁 |
| D、原电池工作时,正极和负极上发生的都是氧化还原反应 |
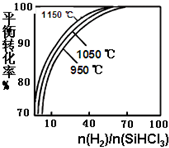 粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;