题目内容
20.工业上制备粗硅的反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列说法正确的是( )| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | C得到电子 |
分析 在氧化还原反应中,得电子化合价降低的反应物是氧化剂,被还原发生还原反应,失电子化合价升高的反应物是还原剂,被氧化发生氧化反应,据此分析解答.
解答 解:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳失电子是还原剂,表现出还原性,被氧化,二氧化硅是氧化剂,发生还原反应,故选B.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,难度不大.

练习册系列答案
相关题目
15.下列说法中不正确的是( )
| A. | 向某未知溶液中滴加NaOH溶液,并加热,在试管口放湿润的红色石蕊试纸,可检验原溶液中是否含有NH4+ | |
| B. | 向某未知溶液中滴加硝酸银溶液,若产生白色沉淀,则证明原溶液中有Cl- | |
| C. | 除去FeCl2溶液中混有的FeCl3可加入过量铁粉,再过滤 | |
| D. | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制氯水,溶液变红色,则该溶液中一定含有Fe2+ |
16.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,18g D2O的原子总数为3NA | |
| B. | 0.1mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| C. | 常温下,5.6g Fe与足量的浓硝酸反应,转移的电子数为0.3 NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
8.VL浓度0.5mol/L的盐酸,欲使其浓度增大1倍,可采取的措施是( )
| A. | 通入标准状况下的HCl气体11.2L | |
| B. | 加入10mol/L的盐酸0.1VL,再稀释至1.5L | |
| C. | 将溶液加热浓缩到0.5VL | |
| D. | 加入2mol/L的盐酸VL混合均匀 |
15.在汽车尾气处理装置中加入适当的催化剂,能发生反应:4CO+2NO2=4CO2+N2.下列有关该反应的说法正确的是( )
| A. | CO发生氧化反应 | B. | NO2是还原剂 | C. | CO是氧化剂 | D. | N元素化合价升高 |
12.根据下列物质中N元素的化合价判断,其中说法错误的是( )
| A. | NH3具有还原性 | B. | N2只具有还原性 | C. | N2只具有氧化性 | D. | HNO3具有氧化性 |
9.水溶液X中只可能溶有Na+、Ca2+、Fe3+、[Al(OH)4]-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶液迸行了如下实验:下列判断正确的是( )
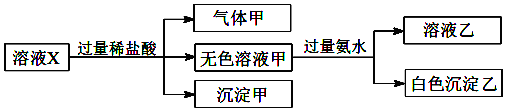

| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | CO32-和SO42-一定不存在于溶液X中 | |
| D. | Na+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
10.下列表述错误的是( )
| A. | C3H8分子中的碳原子一定不在同一直线上 | |
| B. | 乙酸与乙醇反应的化学方程式:CH3COOH+C2H518OH$?_{△}^{浓H_{2}SO_{4}}$CH3CO18OC2H5+H2O | |
| C. | 用溴水不能区分植物油和矿物油,也不能区分CCl4和苯 | |
| D. | 分子式为C5H12O的有机物在Cu的催化作用下发生催化氧化,但产物不能发生银镜反应的有(不考虑立体异构)3 种 |
