题目内容
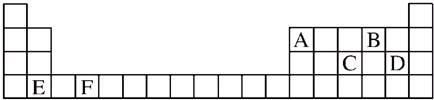
表是元素周期表的一部分,回答下列有关问题:
(1).写出下列元素符号:① ⑥
(2).在①~?元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 ,最高价氧化物具有两性的化合物是 ,最高价氧化物对应水化物具有两性的物质与强碱反应的离子方程式 (均用元素符号作答)
(3).元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是 .
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4).第三周期中原子半径最大的元素是 (填序号),跟它同周期主族元素原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物.
(5)元素③⑦与氢元素形成的一种化合物含有的化学键类型有 .
| 主 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
(2).在①~?元素中,金属性最强的元素是
(3).元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4).第三周期中原子半径最大的元素是
(5)元素③⑦与氢元素形成的一种化合物含有的化学键类型有
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、?为Ca、?为Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体化学性质最不活泼;氧化铝是两性氢氧化物,与强碱反应生成偏铝酸盐与水;
(3)比较元素非金属性,可以根据单质与氢气反应难易或剧烈程度、氢化物稳定性、最高价含氧酸的酸性、单质之间的置换等;
(4)同周期自左而右原子半径减小,故第三周期中Na原子半径最大、Cl原子半径最小;
(5)元素③⑦与氢元素形成的一种化合物为硫酸钠、亚硫酸钠、亚硫酸氢钠等.
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体化学性质最不活泼;氧化铝是两性氢氧化物,与强碱反应生成偏铝酸盐与水;
(3)比较元素非金属性,可以根据单质与氢气反应难易或剧烈程度、氢化物稳定性、最高价含氧酸的酸性、单质之间的置换等;
(4)同周期自左而右原子半径减小,故第三周期中Na原子半径最大、Cl原子半径最小;
(5)元素③⑦与氢元素形成的一种化合物为硫酸钠、亚硫酸钠、亚硫酸氢钠等.
解答:
解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、?为Ca、?为Br,故答案为:N;Si;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强、F的非金属性最强;稀有气体Ar化学性质最不活泼;氧化铝是两性氢氧化物,与强碱反应生成偏铝酸盐与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:K;F;Ar;Al2O3;Al2O3+2OH-=2AlO2-+H2O;
(3)比较元素非金属性,可以根据单质与氢气反应难易或剧烈程度、氢化物稳定性、最高价含氧酸的酸性、单质之间的置换等,单质的状态属于物理性质,不能比较非金属性强弱,与氢氧化钠溶液反应也比较比较非金属性强弱,故ac错误、b正确,故答案为:b;
(4)同周期自左而右原子半径减小,故第三周期中Na原子半径最大、Cl原子半径最小,二者形成很好为NaCl,属于离子化合物,故答案为:③;⑧;离子;
(5)元素③⑦与氢元素形成的一种化合物为硫酸钠、亚硫酸钠、亚硫酸氢钠等,含有离子键、共价键,故答案为:离子键、共价键.
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强、F的非金属性最强;稀有气体Ar化学性质最不活泼;氧化铝是两性氢氧化物,与强碱反应生成偏铝酸盐与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:K;F;Ar;Al2O3;Al2O3+2OH-=2AlO2-+H2O;
(3)比较元素非金属性,可以根据单质与氢气反应难易或剧烈程度、氢化物稳定性、最高价含氧酸的酸性、单质之间的置换等,单质的状态属于物理性质,不能比较非金属性强弱,与氢氧化钠溶液反应也比较比较非金属性强弱,故ac错误、b正确,故答案为:b;
(4)同周期自左而右原子半径减小,故第三周期中Na原子半径最大、Cl原子半径最小,二者形成很好为NaCl,属于离子化合物,故答案为:③;⑧;离子;
(5)元素③⑦与氢元素形成的一种化合物为硫酸钠、亚硫酸钠、亚硫酸氢钠等,含有离子键、共价键,故答案为:离子键、共价键.
点评:本题考查元素周期表与元素周期律,比较基础,侧重对基础知识的巩固,注意整体把握元素周期表的结构,掌握金属性、非金属性强弱比较.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列离子方程式正确的是( )
| A、NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ |
| B、Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ |
| C、向FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
有关常温下pH均为11的氨水和Ba(OH)2溶液的说法正确的是( )
| A、两溶液中,由水电离出的氢氧根离子浓度均为1×10-11mol/L |
| B、分别加水稀释100倍后,两种溶液的pH均变为9 |
| C、氨水中的c(NH+)和Ba(OH)2溶液中的c(Ba2+)相等 |
| D、分别加入等量的pH为1的硫酸,二者的导电能力均减小 |

 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题: