题目内容
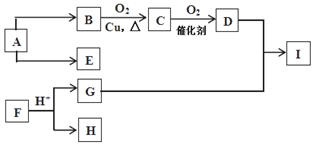
1.设NA代表阿伏加德罗常数的数值.则下列有关叙述正确的是( )| A. | 1molFeI2与足量氯气反应时转移的电子数2 NA | |
| B. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| C. | 7.8g过氧化钠用于呼吸面具中完全反应时转移电子总数为0.1 NA | |
| D. | 将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
分析 A、FeI2与足量氯气反应时,铁元素由+2价变为+3价,碘元素由-1价变为0价;
B、碳酸根的水解导致阴离子个数增多;
C、求出过氧化钠的物质的量,然后根据过氧化钠用于呼吸面具供氧剂时是过氧化钠和二氧化碳反应,此反应是歧化反应;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、FeI2与足量氯气反应时,铁元素由+2价变为+3价,碘元素由-1价变为0价,故1molFeI2与足量氯气反应时,转移3mol电子即3NA个,故A错误;
B、碳酸根的水解导致阴离子个数增多:CO32-+H2O?HCO3-+OH-,故溶液中的阴离子的个数多于0.1NA个,故B错误;
C、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠用于呼吸面具供氧剂时是过氧化钠和二氧化碳反应,此反应是歧化反应,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故C正确;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
18.用含钴废料(含CoCO3、少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图1:
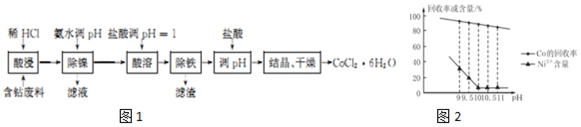
已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
(1)酸浸工艺中用“稀HCl”替代了传统的“盐酸与硝酸的混酸”,其优点为减少有毒气体氮氧化物的排放;防止产品中混有硝酸盐(或防止将Co2+氧化).
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.

已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 6.7 | 9.5 |
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.
9.下面有关pH的说法正确的是( )
| A. | 在pH=12的溶液中.水电离出的c(OH-)定等于10-12mol/L | |
| B. | 将pH=2和pH=l2的酸碱溶液等体积混合后,溶液的pH一定等于7 | |
| C. | 若强酸、强碱中和后pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后.溶液的pH一定大于7 |
16.工业上冶炼钛有如右反应:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$ Ti+2MgCl2该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
13.根据南方某城市环卫局提供的资料,该市平均每天生产垃圾1500t,其中生活垃圾800~900t.下列关于垃圾的说法正确的是( )
| A. | 瓜皮果壳-可回收垃圾 | B. | 医疗垃圾-危险废物 | ||
| C. | 玻璃制品-不可回收垃圾 | D. | 塑料-不可回收垃圾 |
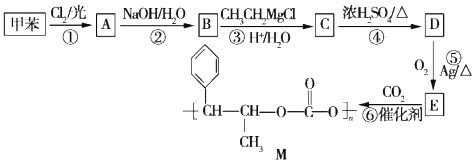
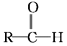 +R′-MgX→
+R′-MgX→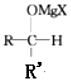 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$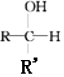 (R,R'均为烃基);
(R,R'均为烃基);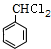 ,D
,D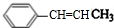 ,E
,E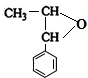 .
. .B与新制的Cu(OH)2悬浊液共热反应
.B与新制的Cu(OH)2悬浊液共热反应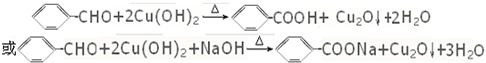 .
.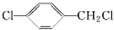 (填结构简式).
(填结构简式).