题目内容
17.已知:用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( )
| A. | 400℃时,生成的产物有N2、NO、H2O | |
| B. | 800℃时,反应的化学方程式是:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O | |
| C. | 400℃-800℃间,Pt-Rh合金对N2的吸附力逐渐减弱 | |
| D. | 800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0 |
分析 A.根据图2知,400℃时,生成的含有N元素的产物有N2、NO且N2产率大于NO;
B.800℃时,生成的含有N元素的产物主要是NO,接近100%;
C.400℃-800℃间,N2的产率下降、NO产率上升,且NO产率接近100%,Pt-Rh合金对N2的吸附力增强;
D.800℃以上,N2的产率上升、NO的产率下降.
解答 解:A.根据图2知,400℃时,生成的含有N元素的产物有N2、NO且N2产率大于NO,同时产物中还有水,故A正确;
B.800℃时,生成的含有N元素的产物主要是NO,接近100%,所以发生的反应为4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O,故B正确;
C.400℃-800℃间,N2的产率下降、NO产率上升,且NO产率接近100%,所以Pt-Rh合金对N2的吸附力增强而不是减弱,故C错误;
D.800℃以上,N2的产率上升、NO的产率下降,说明发生了反应2NO(g)?O2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,△H>0,故D正确;
故选C.
点评 本题考查产率随温度变化曲线,为高频考点,侧重考查学生图象分析、判断能力,明确曲线变化原因是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.已知下列操作和现象,所得结论正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 其他条件不变,缩小H2(g)+I2(g)?2HI(g)的平衡体系的容器容积,气体颜色变深 | 增大压强,平衡逆向移动 |
| B | 分别将乙烯与SO2通入酸性KMnO4溶液中,KMnO4溶液均褪色 | 两种气体使酸性KMnO4溶液褪色的原理不相同 |
| C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴管内有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
| D | 25℃时,分别测定等物质的量浓度的NaCN溶液和NaF溶液的pH,前者pH大 | 酸性:HCN>HF |
| A. | A | B. | B | C. | C | D. | D |
8.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(KMnO4酸性溶液) | ||
| C. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D. | 苯中的甲苯(溴水) |
12. 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H=-99kJ/mol
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如表:
则x=413.
(2)反应①能够自发进行的条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)恒温,恒容密闭容器中,对于反应②,下列说法中能说明该反应达到化学平衡状态的是BD.
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应②,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法
不正确的是ABD.
A.不同条件下反应,N点的速率最大
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入体积比为 3:1的 H2 和CO2发生反应②,则图中M点时,产物甲醇的体积分数为16.7%;若要进一步提高甲醇的体积分数,可采取的措施有增大压强(答一种措施).
(6)甲醇在催化剂条件下可以直接氧化成甲酸.常温下用0.1000mol•L-1NaOH滴定 20.00mL 0.1000mol•L-1的甲酸.当溶液中c(HCOOH)=c(HCOO-)时,测得PH=4.
①PH=4时,该溶液中离子浓度由小到大的顺序为c(OH-)<c(H+)<c(Na+)<c(HCOO-);
②PH=7时,c(HCOOH)+c(HCOO-)>0.050mol•L-1(填“>”、“<”或“=”)
 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H=-99kJ/mol
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)反应①能够自发进行的条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)恒温,恒容密闭容器中,对于反应②,下列说法中能说明该反应达到化学平衡状态的是BD.
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应②,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法
不正确的是ABD.
A.不同条件下反应,N点的速率最大
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入体积比为 3:1的 H2 和CO2发生反应②,则图中M点时,产物甲醇的体积分数为16.7%;若要进一步提高甲醇的体积分数,可采取的措施有增大压强(答一种措施).
(6)甲醇在催化剂条件下可以直接氧化成甲酸.常温下用0.1000mol•L-1NaOH滴定 20.00mL 0.1000mol•L-1的甲酸.当溶液中c(HCOOH)=c(HCOO-)时,测得PH=4.
①PH=4时,该溶液中离子浓度由小到大的顺序为c(OH-)<c(H+)<c(Na+)<c(HCOO-);
②PH=7时,c(HCOOH)+c(HCOO-)>0.050mol•L-1(填“>”、“<”或“=”)
2.分子式为C6H14O且含有“-CH2OH”的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8 种 | C. | 9 种 | D. | 10种 |
9.X、Y是短周期主族元素,常温常压下,两元素形成的单质分别为m、n,m为气态、n为固态,下列推断合理的是( )
| A. | 若X,Y位于IA族,则化合物YX与水反应时水作还原剂 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物只含离子键 | |
| C. | 若氢化物还原性HaX<HbY,则单质氧化性m>n | |
| D. | 若X、Y位于同一主族,则简单离子半径X>Y |
6.下列反应中,不属于可逆反应的是( )
| A. | Cl2与水反应 | |
| B. | 水电解生成H2 和H2在O2中燃烧生成水的相互转化过程 | |
| C. | 工业合成氨 | |
| D. | 氨气与水反应 |
7.将1一氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴的四氯化碳溶液反应,得到一种有机物,它的同分异构体有(除它之外)( )
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
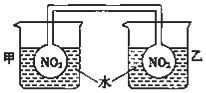 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.