题目内容
13.对于某些离子的检验及结论一定正确的是( )| A. | 加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入KSCN溶液无明显现象,再滴加饱和氯水溶液出现血红色,一定有Fe2+ |
分析 A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,二氧化碳气体遇澄清石灰水变浑浊;
B、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀;
C、湿润红色石蕊试纸遇碱性物质变蓝;
D、氯水具有强氧化性,能氧化亚铁离子为铁离子.
解答 解:A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,加入稀盐酸产生无色气体,不一定有CO32-,故A错误;
B、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,不一定有SO42-,故B错误;
C、湿润红色石蕊试纸遇碱性物质变蓝,加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+,故C正确;
D、向待测液中加入KSCN溶液无现象,待测液中此时不含有铁离子,加入氯水后变为血红色,说明待测液中含有铁离子,即氯水氧化亚铁离子生成铁离子,故说明待测液中含有Fe2+,故D正确;
故选CD.
点评 本题考查硫酸根离子的检验,明确复分解反应发生的条件及离子之间的反应,注意排除某些离子的干扰以及应该加入什么试剂才能排除这些离子的干扰是解答的关键,题目难度不大.

练习册系列答案
相关题目
3.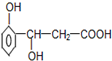 某有机物的结构简式如图所示,它可以发生反应的类型有( )
某有机物的结构简式如图所示,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚.
 某有机物的结构简式如图所示,它可以发生反应的类型有( )
某有机物的结构简式如图所示,它可以发生反应的类型有( )①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
4.下列物质的化学式可以称为分子式的是( )
| A. | NaCl | B. | Cu | C. | CO2 | D. | Na2CO3•10H2O |
1.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 用往氯化铁中加铁粉:Fe+Fe3+═2Fe2+ | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ |
8.下列实验过程中,无明显现象的是( )
| A. | CO2通入CaCl2溶液中 | B. | 胆矾中加入浓硫酸 | ||
| C. | NO2通入FeSO4溶液中 | D. | 饱和的食盐水中滴加浓盐酸 |
18.已知苯的n溴代物和m溴代物的种类数相等(m≠n),则n和m的关系是( )
| A. | m+n=6 | B. | m+n=4 | C. | m+n=8 | D. | 无法确定 |
5.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol•l-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A. | 60mL | B. | 45mL | C. | 30mL | D. | 15mL |
2.元素周期表前四周期的元素中,同一周期的两种主族元素原子的核外电子数差值不可能为( )
| A. | 6 | B. | 8 | C. | 11 | D. | 16 |
15.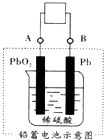 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |