题目内容
1.已知Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )| A. | KCl | B. | K2S | C. | Na2S | D. | Na2O |
分析 根据“Y元素最高正价与最低负价的绝对值之差是4”能推断出元素的化合价;根据电子层结构能推出具体的元素,据此进行解答.
解答 解:根据题意,Y元素最高正价与最低负价的绝对值之差是4,则Y最高正价为+6,Y为S元素,再由Y元素与M元素形成离子化合物且在水中电离出电子层结构相同的离子,推出M为第四周期的金属元素,选项中只有K元素符合,则该化合物为K2S,
故选B.
点评 本题考查原子结构与元素的性质,题目难度不大,推出Y为S元素是解答本题的关键,注意掌握原子结构与元素周期律之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.某有机物甲在稀硫酸中加热水解生成乙和丙,乙在一定条件下可以转化成丙,下列有关甲的分子式与符合该条件的同分异构体数目的判断中不正确的是( )
| 选项 | 分子式 | 同分异构体数目 |
| A | C4H8O2 | 1 |
| B | C6H12O2 | 2 |
| C | C8H16O2 | 3 |
| D | C10H20O2 | 4 |
| A. | A | B. | B | C. | C | D. | D |
9.某烯烃(只含1个双键)与H2加成后的产物是 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
6.下列有关事实的说法正确的是( )
| A. | 用PH试纸可测得某溶液的pH为6.5 | |
| B. | 可用25mL碱式滴定管量取20.00mLKMnO4溶液 | |
| C. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| D. | 把CO中毒的病人放入高压氧仓中解毒,其原理符合勒夏特列原理 |
13.下列反应不属于四个基本反应类型,但属于氧化还原反应的是( )
| A. | Fe+CuSO4=FeSO4+Cu | B. | Cl2+H2O=HCl+HClO | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | AgNO3+HCl=AgCl↓+HNO3 |
10.(1)在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
根据表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应; 在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.可生成0.4mol氨气,则放出(或吸收)的热量为18.6KJ.
(2)下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水
⑤氧气溶于水 ⑥氯化铵受热分解.(本题只填序号)
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
仅发生共价键破坏的是④;既发生离子键又发生共价键破坏的是⑥.
(3)由A、B、C、D四种金属按下表中装置进行实验,根据实验现象得出A、B、C、D四种金属的活泼性由强到弱的顺序为D>A>B>C.
(4)若氢气的燃烧过程中,破坏1molH2中的化学键消耗的能量为Q1kJ,破坏1molO2
中的化学键为Q2kJ,形成1molH2O中的化学键释放的能量为Q3.下列关系式正确的是D
A、Q1+Q2>Q3 B、Q1+Q2<Q3
C、2Q1+Q2>2Q3 D、2Q1+Q2<2Q3.
| 共价键 | H-H | N≡N | H-N |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
(2)下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水
⑤氧气溶于水 ⑥氯化铵受热分解.(本题只填序号)
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
仅发生共价键破坏的是④;既发生离子键又发生共价键破坏的是⑥.
(3)由A、B、C、D四种金属按下表中装置进行实验,根据实验现象得出A、B、C、D四种金属的活泼性由强到弱的顺序为D>A>B>C.
| 装置 | 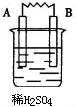 | 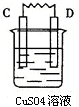 | 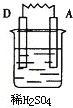 | 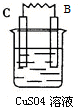 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 | 金属B不断溶解 |
中的化学键为Q2kJ,形成1molH2O中的化学键释放的能量为Q3.下列关系式正确的是D
A、Q1+Q2>Q3 B、Q1+Q2<Q3
C、2Q1+Q2>2Q3 D、2Q1+Q2<2Q3.
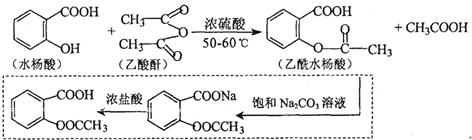
 .
. .
.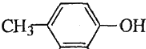 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.
 .
. .化合物
.化合物 是合成药物的中间体,请写出以有机物A和
是合成药物的中间体,请写出以有机物A和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: