题目内容
6.下列有关事实的说法正确的是( )| A. | 用PH试纸可测得某溶液的pH为6.5 | |
| B. | 可用25mL碱式滴定管量取20.00mLKMnO4溶液 | |
| C. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| D. | 把CO中毒的病人放入高压氧仓中解毒,其原理符合勒夏特列原理 |
分析 A.根据pH试纸测得某溶液的pH为整数解答;
B.高锰酸钾具有氧化性,腐蚀橡皮管;
C.石油、煤、天然气、可燃冰为化石燃料;
D.根据浓度对化学平衡的影响分析.
解答 解:A.pH试纸测得某溶液的pH为整数,不是小数,故A错误;
B.碱式滴定管具有橡皮管和玻璃球构成的尖嘴,高锰酸钾具有氧化性,腐蚀橡皮管,应用酸式滴定管,故B错误;
C.石油、煤、天然气、可燃冰为化石燃料,而植物油不属于化石燃料,故B错误;
D.一氧化碳中毒的反应原理为:CO+Hb•O2?O2+Hb•CO,当增大氧气的浓度时,使化学反应平衡向逆反应方向移动,从而使一氧化碳和血红蛋白分离而解毒,所以符合勒夏特列原理,故D正确;
故选D.
点评 本题考查了实验基本操作、化石燃料、化学平衡等知识,题目难度不大,注意相关知识的积累,特别是把CO中毒的病人放入高压氧仓中解毒原理,为易错选项.

练习册系列答案
相关题目
16.A、B、C、D、E、F六种元素,其中ABCDE为短周期元素,①原子半径A<C<B<E<D②原子最外层电子数A=D、C=E、A+B=C③原子的核外电子层数B=C=2A④B元素的最高正价与最低负价数值之差为2⑤F在地壳中金属元素含量第二,下列说法正确的是( )
| A. | 因为C的氢化物分子内含有氢键,所以比E的氢化物稳定 | |
| B. | 过量F与氯气加热完全反应,得到相应的低价态氯化物 | |
| C. | 因为E单质相对分子量小于溴单质的相对分子量,所以E单质熔点比溴低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
1.已知Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | K2S | C. | Na2S | D. | Na2O |
11.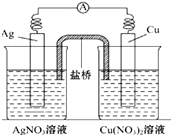 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )| A. | 在外电路中,电流由铜电极流向银电极 | |
| B. | 该装置是将电能转化为化学能 | |
| C. | 实验过程中取出盐桥,原电池仍继续工作 | |
| D. | 正极反应为:Ag++e-═Ag |
18.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“至少在距今3000年以前,中国就已经使用玻璃了.”下列关于玻璃的叙述中,正确的是( )
| A. | 玻璃是人类最早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制造普通玻璃的原料主要是纯碱、粘土和石英 | |
| D. | 普通玻璃生产中所涉及的两个主要反应均有CO2生成 |
15.应用元素周期律分析,下列推断正确的是( )
| A. | 第3周期元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅥA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,Tl(OH)3为两性氢氧化物 |
 ;
;