题目内容
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
分析 A.1mol铝反应生成铝离子失去3mol电子;
B.依据n=CV计算碳酸钠的物质的量,1mol碳酸钠含有2mol钠离子;
C.常温常压Vm>22.4L/mol;
D.气体摩尔体积使用对象为气体.
解答 解:A.0.5 mol Al与足量盐酸反应转移电子数为1.5NA,故A错误;
B.500mL 1mol/LNa2CO3溶液中含有碳酸钠的物质的量为0.5L×1mol/L=0.5mol,含有Na+离子数目为NA,故B正确;
C.常温常压Vm>22.4L/mol,11.2LO2(g)物质的量小于0.5mol,含有O2分子数目小于0.5NA,故C错误;
D.标准状况下,水是液体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数有关计算及应用,明确以物质的量为核心的计算公式,熟悉气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
相关题目
5.下列关于物质的量的叙述中,正确的是( )
| A. | 1 mol任何物质中都含有6.02×1023个分子 | |
| B. | 0.012 kg 12C中含有约6.02×1023 NA个碳原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol Ne中约含有6.02×1024个电子 |
9.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 71 g Cl2所含原子数为2NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
19.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | Cu(OH)2+2HCl═CuCl2+2H2O | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
6.关于某混合物的说法正确的是( )
| A. | 构成物质一定是化合物 | |
| B. | 构成物质一定是单质 | |
| C. | 构成物质可能只有一种元素 | |
| D. | 物质的组成元素一定是两种或两种以上 |
3.蒸干下列溶液能得到原溶液中溶质的是( )
| A. | AlCl3 | B. | Cu(NO3)2 | C. | FeSO4 | D. | Na2CO3 |
10.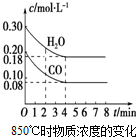 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①若c1数值大于0.08mol•L-1,则温度t>850℃(填“>”“<”或“=”).
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.
 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0(1)在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃时CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol•(L•min)-1.
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
②表中3~4min之间反应处于平衡 状态.
③若第5min时,该反应处于化学平衡状态,则此反应的平衡常数K=0.35(保留两位有效数字)
④表中5~6min之间数值发生变化,可能的原因是B.
A.升高温度
B.体积不变,通入水蒸气
C.缩小体积,增大压强
D.体积不变,通入氢气
⑤比较反应物CO在2~3min、5~6min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)表示]的大小v(2~3)>v(5~6)(假设3~5min内反应条件不变).
⑥能使该反应的反应速率增大,且平衡向正反应方向移动的措施是C.
A.适当升高温度 B.缩小反应容器的体积C.增大CO的浓度 D.选择高效催化剂.