题目内容
实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图如图所示:
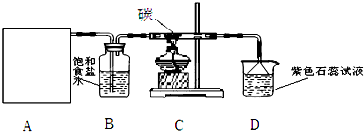
(1)A是氯气发生装置,请完成反应的离子方程式为 .除了酒精灯和导管外,还用到的玻璃仪器有 .
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式 .
(3)同学们在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成.“影响氯气生成的原因是什么呢?”,同学们作了如下探究:
①提出合理假设
假设1:Cl-的浓度对反应的影响;假设2: .

(1)A是氯气发生装置,请完成反应的离子方程式为
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式
(3)同学们在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成.“影响氯气生成的原因是什么呢?”,同学们作了如下探究:
①提出合理假设
假设1:Cl-的浓度对反应的影响;假设2:
考点:氯气的实验室制法
专题:实验题
分析:(1)实验室是用二氧化锰和浓盐酸反应制氯气,反应生成氯气、二氯化锰、水,依据离子方程式书写方法,易溶于水的强电解质拆成离子;根据制取氯气的反应条件及使用的试剂选择选择使用的玻璃仪器;
(2)根据反应物为氯气、水和C,生成物为二氧化碳和氯化氢写出反应的化学方程式;
(3)浓盐酸和稀盐酸的区别在于溶液中氢离子和氯离子浓度大小,可以分别设计实验方案证明是氯离子浓度影响反应还是氢离子浓度影响反应;
(2)根据反应物为氯气、水和C,生成物为二氧化碳和氯化氢写出反应的化学方程式;
(3)浓盐酸和稀盐酸的区别在于溶液中氢离子和氯离子浓度大小,可以分别设计实验方案证明是氯离子浓度影响反应还是氢离子浓度影响反应;
解答:
解:(1)实验室是用二氧化锰和浓盐酸反应制氯气,反应生成氯气、二氯化锰、水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++2Cl-+Cl2↑+2H2O;制取氯气的反应中,反应需要加热,用到酒精灯;反应物为浓盐酸和二氧化锰,浓盐酸盛放在分液漏斗中,二氧化锰盛放在圆底烧瓶中,还需要用到导管进行连接仪器,
故答案为:MnO2+4H++2Cl-
Mn2++2Cl-+Cl2↑+2H2O;分液漏斗、圆底烧瓶、导管;
(2)C装置中的反应物为氯气、水和碳,生成物为氯化氢和二氧化碳,根据化学方程式书写原则写出化学方程式为:2Cl2+2H2O+C
4HCl+CO2↑,
故答案为:2Cl2+2H2O+C
4HCl+CO2↑;
(3)稀盐酸中含有的离子是氯离子和氢离子,故猜想2为H+的浓度对反应的影响,若证明氯离子的浓度对反应是否有影响,可增大氯离子的浓度,观察是否产生黄绿色气体,若证明氢离子浓度对反应是否有影响,可增大氢离子浓度,观察是否产生黄绿色气体氯气,因此实验方案如下:
①稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热;若有黄绿色气体生成,则与氯离子浓度有关,若没有黄绿色气体生成,则与氯离子浓度无关;
②将将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热;若有黄绿色气体生成,则与氢离子浓度有关,若没有黄绿色气体生成,则与氢离子浓度无关;
故答案为:H+的浓度对反应的影响;
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)C装置中的反应物为氯气、水和碳,生成物为氯化氢和二氧化碳,根据化学方程式书写原则写出化学方程式为:2Cl2+2H2O+C
| ||
故答案为:2Cl2+2H2O+C
| ||
(3)稀盐酸中含有的离子是氯离子和氢离子,故猜想2为H+的浓度对反应的影响,若证明氯离子的浓度对反应是否有影响,可增大氯离子的浓度,观察是否产生黄绿色气体,若证明氢离子浓度对反应是否有影响,可增大氢离子浓度,观察是否产生黄绿色气体氯气,因此实验方案如下:
①稀盐酸加入二氧化锰中,然后滴入氯化钠固体加热;若有黄绿色气体生成,则与氯离子浓度有关,若没有黄绿色气体生成,则与氯离子浓度无关;
②将将稀盐酸加入二氧化锰中,然后滴入浓硫酸,加热;若有黄绿色气体生成,则与氢离子浓度有关,若没有黄绿色气体生成,则与氢离子浓度无关;
故答案为:H+的浓度对反应的影响;
点评:本题考查了氯气的实验室制法及氯气的化学性质,题目难度较大,涉及了实验方案的设计,要求学生能够根据物质的不同点找出影响反应速率的因素,并且能够设计实验方案证明,本题旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
某有机物A与氢气的相对密度是38,取有机物A 7.6g完全燃烧后,生成0.2molCO2和0.2molH2O.此有机物可与氢氧化钠和碳酸钠反应.下列有关A的说法中不正确的是( )
| A、A的分子式为C2H4O3 |
| B、A的结构简式为HO-CH2-COOH |
| C、1 mol A与足量的单质Na反应时放出H2的物质的量为1.0mol |
| D、A分子中的官能团有两种,这两种官能团之间不能发生反应 |
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)?xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol?L-1?min-1,下列说法正确的是( )
| A、反应速率v(B)=0.25 mol?L-1?min-1 |
| B、该反应方程式中,x=1 |
| C、2min时,A的物质的量为1.5mol |
| D、2min时,A的转化率为60% |