题目内容
2.下列说法正确的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
分析 A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱.
C.根据混合液中的电荷守恒分析;
D.溶液中含有Na+离子,离子的总浓度增大.
解答 解:A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=14-a,如为碱溶液,则pH=a,故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4、④NH3•H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解,④弱碱电离,且电离的程度很弱则c(NH4+)由大到小的顺序是:①>②>③>④,故B正确;
C.Na2S和NaHS的混合溶液中,根据电荷守恒可得:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C错误;
D.往其中加入少量NaCl粉末,平衡向左移动,溶液中含有Na+离子,离子的总浓度增大,故D错误.
故选B.
点评 本题考查离子浓度大小的比较,题目难度中等,熟悉酸的强弱与盐的水解的关系,电荷守恒、水解与电离的程度及相互影响是解答本题的关键.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
13.下列叙述的两个量,一定相等的是( )
| A. | 0.1mol•L-1NaNO3与0.05mol•L-1Na2CO3溶液中的Na+离子数目 | |
| B. | 质量相等的石墨和C60中的碳原子数目 | |
| C. | 标准状况下等体积的SO2与SO3的分子数目 | |
| D. | pH都为3的稀盐酸与AlCl3溶液中,由水电离产生的H+离子数目 |
17.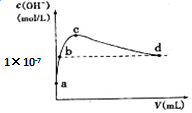 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | d点溶液中:c(Na+)═2c(CO32-)+c(HCO3-) | |
| B. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
7.下列叙述正确的是( )
| A. | 2 mol H2O的质量为36g/mol | |
| B. | NH3的摩尔质量为17g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,3 mol任何物质体积均为67.2L |
12.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、Na+、SO42- | |
| B. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、Cl-、NO3- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |


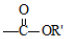 +
+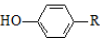 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$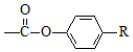 +HOR′
+HOR′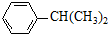 .
.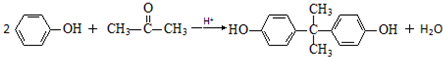 .
.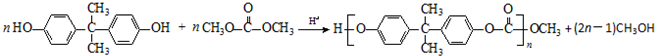 .
.