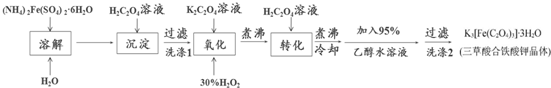
题目内容
14.下列叙述不正确的是( )| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
分析 A.两种离子电子层结构相同,则其核外电子总数相等,据此列式计算;
B.中子数=质量数-质子数,据此分别计算出该化合物中含有的电子总数、中子总数;
C.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断;
D.ⅥA族中,O的非金属性最强,且水中含氢键.
解答 解:A.若aXm+和bYn-两种离子电子层结构相同,则两种离子的核外电子总数相等,即:a-m=b+n,整理可得:a-b=m+n,故A错误;
B.24Mg32S中含有的电子总数为:12+16=28,含有的中子总数为:24-12+32-16=28,所以电子总数与中子总数之比为1:1,故B正确;
C.CO2中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子结构,氧元素化合价的绝对值是+2,氧原子最外层电子数是6,2+6=8,所以氧原子满足8电子结构;PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构,根据分析可知,CO2和PC13分子中各原子最外层都满足8电子结构,故C正确;
D.ⅥA族中,O的非金属性最强,且水中含氢键,则ⅥA族元素的氢化物中稳定性最好的,其沸点也最高,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,把握元素在周期表中的位置、性质即可解答,注意掌握原子的电子数、质子数、中子数之间的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.有机反应①酯化反应 ②取代反应 ③消去反应 ④加成反应 ⑤水解反应 ⑥还原反应.能在有机物的分子中引入羟基官能团的反应类型的组合正确是( )
| A. | ①②④⑥ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ②③④ |
5.某无色混合气体中可能含有Cl2、SO2、NO、NO2、CO2 中的两种或多种气体.现将此无色的混合气体通过品红溶液后,品红溶液褪色,把剩余气体接触空气,很快变为红棕色.对于原混合气体成分的判断正确的是( )
| A. | 一定有NO2和Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
9.下列关于化学用语的表述正确的是(( )
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为  | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
19.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
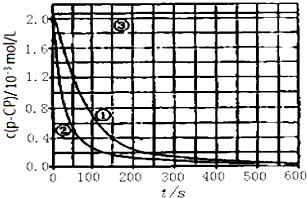
(2)请根据如图实验①曲线,计算降解反应在50-150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验③得出的结论是:pH等于10时,反应速率趋向于零(或该降解反应趋于停止).
(5)根据题意:在一定条件下H2O2和Fe2+的离子反应式H2O2+2H++2Fe2+=2H2O+2Fe3+.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |

(2)请根据如图实验①曲线,计算降解反应在50-150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验③得出的结论是:pH等于10时,反应速率趋向于零(或该降解反应趋于停止).
(5)根据题意:在一定条件下H2O2和Fe2+的离子反应式H2O2+2H++2Fe2+=2H2O+2Fe3+.
6.区别植物油和矿物油的正确方法是( )
| A. | 加水,振荡 | B. | 加Na0H溶液,煮沸 | C. | 加Na2SO4溶液 | D. | 直接观察 |
4.下列各物质的熔点比较正确的是( )
| A. | K>Na | B. | 金刚石>SiO2 | C. | SiH4>CH4 | D. | KCl>NaCl |