题目内容
5. 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)H=-87kJ/mol,该反应在低温条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
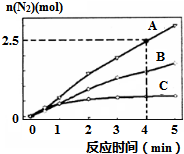
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①0~4分钟在A催化剂作用下,反应速率υ(N2)=0.3125mol•L-1•min-1;
②下列说法正确的是CD;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)?Ag(NH3)2+ (aq),该反应平衡常数的表达式为
K稳=$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
②计算得到可逆反应AgCl (s)+2NH3(aq)?Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=2.5×10-3,1L 1mol/L氨水中最多可以溶解AgCl0.045mol(保留2位有效数字);
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2═CH-CN),该反应的化学方程式为2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O.
分析 (1)已知:反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol
由盖斯定律Ⅰ+Ⅱ-Ⅲ可得2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l),据此计算;再由△G=△H-T△S<0反应自发进行判断;
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A、相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B、催化剂改变反应速率不改变化学平衡;
C、单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D、该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比列式;
②列出可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K,处理变形K=Ksp(AgCl)×K稳计算,;1L 1mol/L氨水中最多可以溶解AgCl可以依据化学平衡常数计算;
(4)氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2═CH-CN)的方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O.
解答 解:(1)已知:反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H=+44.0kJ/mol
由盖斯定律Ⅰ+Ⅱ-Ⅲ可得2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l)H=-87 kJ/mol;该反应气体分子数减少,所以△S<0,则当温度较低时,△G=△H-T△S<0;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2 (s)+H2O(l)H=-87 kJ/mol;低温;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{2.5mol÷2L}{4min}$=0.3125mol•L-1•min-1;
故答案为:0.3125mol•L-1•min-1;
②A、相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B、使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C、单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D、该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①Ag+(aq)+2NH3(aq)?Ag(NH3)2+ (aq),该反应平衡常数的表达式为$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
故答案为:$\frac{c[Ag(N{H}_{3}{)_{2}}^{+}]}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$$•\frac{c(A{g}^{+})}{c(A{g}^{+})}$=Ksp(AgCl)×K稳=2.50×10-10×1.00×107=2.5×10-3;
设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数K=$\frac{{x}^{2}}{(1-2x)^{2}}$=2.5×10-3,解得x=0.045;
故答案为:2.5×10-3;0.045;
(4)由氨、丙烯和空气为原料,一定条件下合成丙烯腈方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;
故答案为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用、化学平衡影响因素分析判断、平衡常数和溶度积常数计算的应用、反应速率计算、平衡状态的判断等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 工业合成氨中,将氨气液化分离以提高氨气产率 | |
| B. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 两支试管中分别加入等体积5%的H3O2溶液,在其中一支试管中加入2~3滴FeCl3溶液,该试管中产生气泡快 |
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
 .
.
 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题: