题目内容
4.已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol•L-1,放出热量为Q2 kJ.(1)达到平衡时,A2的转化率为$\frac{{Q}_{2}}{{Q}_{1}}$.
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将不变(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度=(填>、=、<)w mol•L-1,Q1、Q2、Q3 之间满足何种关系:Q3=Q1-Q2
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是ad;
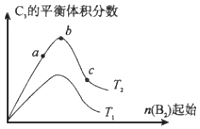
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4molA2和2molB2,500℃时充分反应达平衡后,放出热量Q4kJ,则Q2<Q4 (填“>”、“<”或“=”).
(6)下列措施可以同时提高反应速率和B2的转化率是d(填选项序号).
a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度.
分析 (1)该反应中如果有2molA2完全反应,则放出Q1kJ热量,则放出Q2kJ热量时消耗n(A2)=$\frac{{Q}_{2}}{{Q}_{1}}×2mol$,A2的转化率=$\frac{\frac{{Q}_{2}}{{Q}_{1}}×2mol}{2mol}$;
(2)达到平衡后,若向原容器中通入少量的氩气,容器体积不变,则反应物和生成物浓度不变,平衡不移动;
(3)相同温度下,若在原来的容器中,只加入2mol C3,如果加入2molA2和1molB2是等效平衡,两种情况下达到平衡状态时两个容器中C3浓度相等;
相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,两个容器中放出热量之和等于Q1;
(4)a.相同温度下,反应物浓度越大,反应速率越大;
b.相同温度下,B2的物质的量越大,达到平衡时A2的转化率越大;
c.该反应的正反应是放热反应,升高温度平衡逆向移动,生成物体积分数减小;
d.当反应物的物质的量之比等于其计量数之比时,生成物的体积分数最大;
(5)该反应前后气体物质的量减小,压强减小,如果是在恒压条件下进行反应,相当于增大压强,平衡正向移动,则反应物的转化率增大;
(6)a.选择适当的催化剂,只增大反应速率但平衡不移动;
b.增大压强,正逆反应速率都增大,平衡向气体体积减小的方向移动;
c.及时分离生成的C3,平衡正向移动,但反应速率减小;
d.升高温度,平衡逆向移动.
解答 解:(1)该反应中如果有2molA2完全反应,则放出Q1kJ热量,则放出Q2kJ热量时消耗n(A2)=$\frac{{Q}_{2}}{{Q}_{1}}×2mol$,A2的转化率=$\frac{\frac{{Q}_{2}}{{Q}_{1}}×2mol}{2mol}$=$\frac{{Q}_{2}}{{Q}_{1}}$,
故答案为:$\frac{{Q}_{2}}{{Q}_{1}}$;
(2)达到平衡后,若向原容器中通入少量的氩气,容器体积不变,则反应物和生成物浓度不变,平衡不移动,则A2的转化率不变,故答案为:不变;
(3)相同温度下,若在原来的容器中,只加入2mol C3,如果加入2molA2和1molB2是等效平衡,两种情况下达到平衡状态时两个容器中C3浓度相等,所以C3浓度=wmol/L;
相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,两个容器中放出热量之和等于Q1,所以Q3=Q1-Q2,
故答案为:=;Q1-Q2;
(4)a.相同温度下,反应物浓度越大,反应速率越大,所以反应速率c>b>a,故正确;
b.相同温度下,B2的物质的量越大,达到平衡时A2的转化率越大,所以转化率c>b>a,故错误;
c.该反应的正反应是放热反应,升高温度平衡逆向移动,生成物体积分数减小,所以T2<T1
,故错误;
d.当反应物的物质的量之比等于其计量数之比时,生成物的体积分数最大,所以b点A2和B2的物质的量之比为2:1,故正确;
故选ad;
(5)该反应前后气体物质的量减小,压强减小,如果是在恒压条件下进行反应,相当于增大压强,平衡正向移动,则反应物的转化率增大,所以Q2<Q4,故答案为:<;
(6)a.选择适当的催化剂,只增大反应速率但平衡不移动,不符合条件,故错误;
b.增大压强,正逆反应速率都增大,平衡向气体体积减小的方向移动,平衡正向移动,符合条件,故正确;
c.及时分离生成的C3,平衡正向移动,但反应速率减小,不符合条件,故错误;
d.该反应的正反应是放热反应,升高温度,平衡逆向移动,不符合条件,故错误;
故选b.
点评 本题考查化学平衡计算、化学平衡影响因素等知识点,侧重考查学生分析判断能力,明确等效平衡及正确构建等效平衡是解本题关键,注意:(4)d中反应物物质的量之比等于计量数之比时产物的含量最大,为易错点.

 优等生题库系列答案
优等生题库系列答案| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
| A. | 生物质能的缺点是严重污染环境 | |
| B. | 生物质能源是可再生的能源 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 使用沼气这种生物质能是对化学能的充分利用 |
| A. | 中和时所需NaOH的量 | B. | 与Mg反应的起始速率 | ||
| C. | OH-的物质的量浓度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
| A. | 若将容器压缩时,正逆反应速率均不变 | |
| B. | 5 min内平均反应速率v(X)=0.02 mol/(L•min) | |
| C. | 向平衡后的体系中加入l molM(s),平衡向逆反应方向移动 | |
| D. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
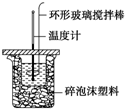 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.