题目内容
17.下列各离子组在指定的溶液中一定能大量共存的是( )①常温在C(H+)/C(OH-)=10-10溶液中:K+、Na+、CH3COO-、SO42-
②常温pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液中:Cl-、NO3-、Na+、S2O32-
④使甲基橙变红色的溶液中:Fe3+、NO3-、Na+、SO42-.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
分析 ①常温在c(H+)/c(OH-)=10-10溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
②常温pH=11的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液中存在大量氢离子或氢氧根离子,S2O32-与与氢离子反应,酸性条件下硝酸根离子能够氧化S2O32-;
④使甲基橙变红色的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:①常温在c(H+)/c(OH-)=10-10溶液呈碱性,K+、Na+、CH3COO-、SO42-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故①正确;
②常温pH=11的溶液呈碱性,溶液中存在大量氢氧根离子,CO32-、Na+、AlO2-、NO3-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③水电离出的H+浓度c(H+)=10-12mol•L?1的溶液呈酸性或碱性,NO3-、S2O32-在酸性条件下发生氧化还原反应,在酸性溶液中不能大量共存,故③错误;
④使甲基橙变红色的溶液呈酸性,溶液中存在大量氢离子,Fe3+、NO3-、Na+、SO42-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故④正确;
故选B.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | KMnO4→O2 | B. | CO 2→CO | C. | Fe2O 3→Fe | D. | Br→Br2 |
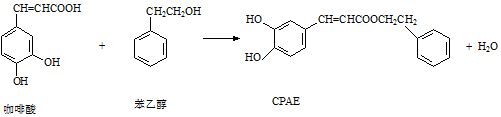
下列说法正确的是( )
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 | |
| C. | 不能用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
(1)已知一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).

(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
| 编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
| ① | 25℃ | 10.0 | 0 | 10.0 | |
| ② | 25℃ | 5.0 | a | 10.0 | |
| ③ | 45℃ | 10.0 | 0 | 10.0 |
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或锰离子的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入C(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
| A. | 中和时所需NaOH的量 | B. | 与Mg反应的起始速率 | ||
| C. | OH-的物质的量浓度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等.若将两溶液稀释相同的倍数后,pH(A)<pH(B) (填“>”、“=”或“<”).现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)<V(B)(填“>”、“=”或“<”).
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR-,HR-?R2-+H+,若0.1mol•L-1NaHR溶液的c(H+)=a mol•L-1,则0.1mol•L-1H2R溶液中c(H+)< (0.1+a) mol•L-1(填“<”、“>”或“=”),理由是H2R中第一步电离出的H+对HR-的电离产生了抑制作用.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
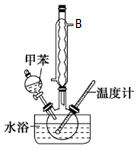 硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.请回答下列问题:
(1)仪器B的名称是球形冷凝管,其作用是冷凝、回流.
(2)过滤在分液漏斗中洗涤静后,有机层处于下层(填“上”或“下”)放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有分液漏斗上口塞子未打开.
(3)上述新的试验方法中过滤的目的是回收NaHSO4,滤液用5%NaHCO3溶液洗涤的原因是除去硫酸、硝酸、乙酸.
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率 (%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 82.0 |
| 1.2 | 36.5 | 59.2 | 4.0 | 83.8 | |
NaHSO4 | 0.25 | 46.3 | 52.8 | 0.9 | 92.8 |
| 0.32 | 48.0 | 51.7 | 0.3 | 95.0 | |
| 0.36 | 45.0 | 54.4 | 0.6 | 93.9 | |
②由表中数据可知甲苯硝化主要得到对硝基甲苯和邻硝基甲苯,原因是苯环上的甲基使苯环上连接甲基的碳原子的邻对位硝化反应更容易进行.
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优有在硝化产物中对硝基甲苯比例提高(或催化剂用量少且能循环使用)(回答一条)
④对硝基甲苯和邻硝基甲苯的部分物理特性如表:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

其中,操作1的名称为分液;操作2中需要使用下列仪器中的ABC(填序号).
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 E.蒸发皿.
| A. | 氧化剂和还原剂物质的量之比为5:4 | |
| B. | 3 mol H2S可还原4mol的KIO3 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
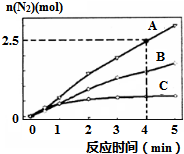 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.