题目内容
7.1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.(夹持装置已略去)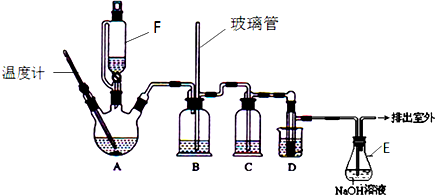
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.D中发生反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象.b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是吸收挥发出来的溴,防止污染环境.
(5)若产物中有少量副产物乙醚.可用蒸馏(填操作名称)的方法除去.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
分析 (1)A中主要发生的是乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,必须注意反应温度.乙烯与液溴发生加成反应生成1,2-二溴乙烷;
(2)依据当堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(3)c中放氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
(4)反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用E中NaOH溶液吸收;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)1,2-二溴乙烷的凝固点较低(9℃).
解答 解:(1)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,D中是乙烯与液溴发生加成反应生成1,2-二溴乙烷,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br;
(2)发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3)制取乙烯中产生的杂质气体二氧化碳和二氧化硫等酸性气体用氢氧化钠溶液吸收,故答案为:c;
(4)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置E中氢氧化钠溶液的作用是吸收HBr和Br2等气体,防止大气污染,
故答案为:吸收挥发出来的溴,防止污染环境;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞,
故答案为:1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、理解能力及化学实验能力.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 用苯萃取碘水中的碘,后分液,水层从上口倒出 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 三氯化铁溶液滴入氢氧化钠溶液可制备氢氧化铁胶体 | |
| D. | 可用量筒准确量取9.5ml水 |
| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
Ⅰ.向铁硼矿粉中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量双氧水,再调节溶液的pH约为5;
Ⅲ.过滤,将所得滤液蒸发浓缩、冷却结晶、过滤得粗硼酸和含镁盐的母液;
Ⅳ.粗硼酸精制得硼酸.
已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
请回答:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4.
(2)为提高步骤I中的反应速率,可采取的措施有升高温度、适当增大硫酸的浓度或减小铁硼矿粉的粒径等(写出两条).
(3)步骤Ⅱ的目的是将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物沉淀而除去.
(4)“粗硼酸”中的主要杂质是MgSO4.
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |