题目内容
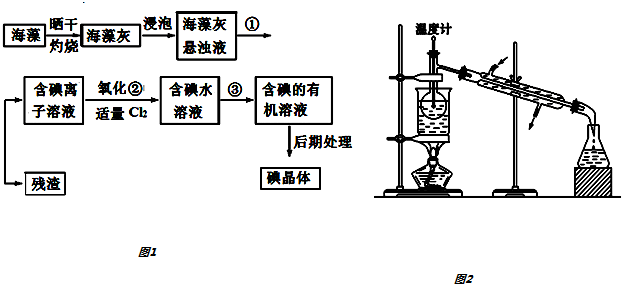
15.海藻中含有丰富的碘元素(以I-形式存在).实验室中提取碘的流程如下:
(1)实验操作③的名称是萃取分液,所用主要仪器名称为分液漏斗.
(2)提取碘的过程中,可供选择的有机试剂是BD(填序号).
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)C溶液,反应的离子方程式为ICl+I-=Cl-+I2.
A.KIO3 B.HClO C.KI D.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示).请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充).
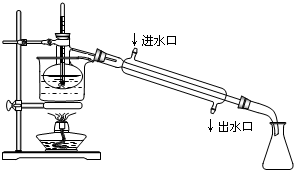
①缺石棉网,②温度计插到了液体中,③冷凝管进出水方向颠倒,④..
(5)实验中使用水浴的原因是有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管,最后晶体碘聚集在蒸馏烧瓶(填仪器名称)中.
分析 (1)依据碘单质的溶解性,萃取原理解答,萃取实验的主要仪器为分液漏斗;
(2)依据萃取操作中萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,判断解答;
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,则需要加入还原剂,结合所给物质的性质解答;氯化碘氧化碘离子生成单质碘和氯离子;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度;为达到最佳冷凝效果冷凝水与蒸汽流向相反,据此解答;
(5)有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管,所以实验中使用水浴.碘是固态,因此最后晶体碘聚集在蒸馏烧瓶中.
解答 解:(1)碘易溶在有机溶剂中,碘水中提取碘应选择萃取,则实验操作③的名称是萃取分液,萃取实验所用主要仪器名称为分液漏斗;
故答案为:萃取分液;分液漏斗;
(2)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂.
A.酒精(沸点78℃)与水互溶,不能作萃取剂,故A错误;
B.四氯化碳(沸点77℃)不溶于水,且碘易溶在四氯化碳中,可以作萃取剂,故B正确;
C.甘油(沸点290℃)易溶于水,不能作萃取剂,故C错误;
D.苯(沸点80℃) 不溶于水,且碘易溶在苯中,可以作萃取剂,故D正确;
故答案为:BD.
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,则需要加入还原剂,碘酸钾、次氯酸、溴均具有强氧化性,碘化钾具有还原性,可以选择碘化钾,反应的离子方程式为:ICl+I-=Cl-+I2,答案选C;
故答案为:C;ICl+I-=Cl-+I2;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度,温度计水银球应放在支管口处;为达到最佳冷凝效果冷凝水与蒸汽流向相反,即下口入,上口出;根据装置图可知,错误有:①缺石棉网;②温度计插到了液体中;③冷凝管进出水方向颠倒;
故答案为:①缺石棉网;②温度计插到了液体中;③冷凝管进出水方向颠倒;
(5)有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管,所以实验中使用水浴.碘是固态,因此最后晶体碘聚集在蒸馏烧瓶中;
故答案为:有机溶剂沸点较低,控制温度不能过高,避免碘蒸气进入冷凝管;蒸馏烧瓶.
点评 本题考查从海带中提取碘的有关实验设计与探究,涉及物质的制备、分离与提纯,明确卤族元素对应物质的性质,熟悉萃取、蒸馏的实验原理和操作是解题关键,侧重考查学生分析能力和解决问题能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 溶质所含离子 | SO42- | M | Mg2+ | Fe2+ |
| 物质的量浓度 | c | 3 | 3 | 2 |
| A. | 若M是NO3-,则c为3.5 | |
| B. | 若使Fe2+浓度降低,可以加入试剂NaOH | |
| C. | 若M是NH4+,则配制溶液所用的溶质不一定是3种 | |
| D. | 若加入BaCl2溶液能产生两种沉淀,则M可能是CO32- |
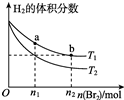 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 由图可知:T1<T2 | |
| B. | a、b两点的正反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率,可在其他条件不变时,将体积变为V/2 L | |
| D. | T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
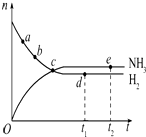 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
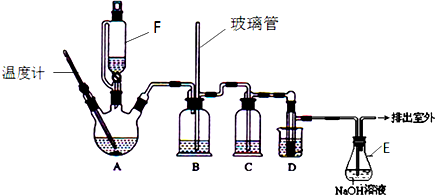
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.D中发生反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象.b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是吸收挥发出来的溴,防止污染环境.
(5)若产物中有少量副产物乙醚.可用蒸馏(填操作名称)的方法除去.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
| A. | 大力实施矿物燃料的脱硫脱硝技术可以减少SO2、NOx的排放 | |
| B. | PM2.5是直径≤2.5微米的细颗粒物,其表面积大,易附带有毒有害物质 | |
| C. | O3能消毒杀菌,空气中O3浓度越大越有利于人体健康 | |
| D. | 汽车尾气中的CO主要来自汽油的不完全燃烧 |
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |