题目内容
17.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0 达到化学平衡时.下列有关叙述正确的是( )| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
分析 A.为可逆反应,1molMHx(s)与ymolH2(g)不能完全反应;
B.恒温恒容的密闭容器中,气体的物质的量与压强成正比;
C.反应为放热,反应升高温度,平衡正向移动;
D.通入少量氢气,平衡正向移动.
解答 解:A.为可逆反应,1molMHx(s)与ymolH2(g)不能完全反应,则吸收y mol H2需大于1 mol MHx,故A错误;
B.恒温恒容的密闭容器中,气体的物质的量与压强成正比,储氢时气体的物质的量减小,则平衡时容器内气体压强减小,故B正确;
C.反应为放热,反应降低温度,平衡正向移动,则该反应的平衡常数增大,故C正确;
D.通入少量氢气,平衡正向移动,则v(放氢)<v(吸氢),故D错误;
故选BC.
点评 本题考查化学平衡移动,为高频考点,把握化学平衡移动的影响因素为解答的关键,侧重分析与应用能力的考查,注意K与温度的关系,选项B为易错点,题目难度不大.

练习册系列答案
相关题目
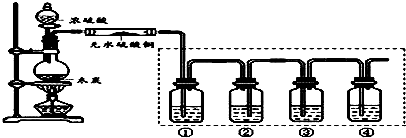
7.1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.(夹持装置已略去)
有关数据列表如下:
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.D中发生反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象.b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是吸收挥发出来的溴,防止污染环境.
(5)若产物中有少量副产物乙醚.可用蒸馏(填操作名称)的方法除去.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.D中发生反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象.b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是吸收挥发出来的溴,防止污染环境.
(5)若产物中有少量副产物乙醚.可用蒸馏(填操作名称)的方法除去.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
5.在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是( )
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |
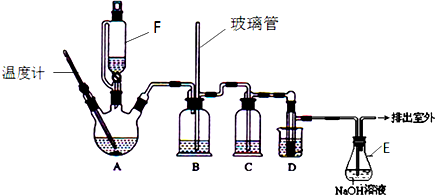
9.某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的还原性,填写了如表.
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
(4)该小组用如图装置进行探究:

(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
(1)在实验前,依据Fe2+的还原性,填写了如表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
(4)该小组用如图装置进行探究:

| 步骤 | 操作及现象 | 解释或结论 |
| ① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由Fe2+与NO或NO2反应而的得到 |
| ② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的排净乙装置及导气管中的NO2 |
| ③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为3NO2+H2O=2HNO3+NO |
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
6.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.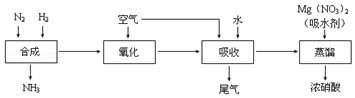
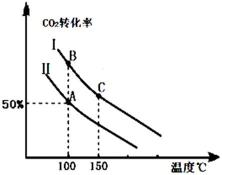 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.